Содержание
- 2. Основания – это сложные вещества, состоящие из атома металла и одной или нескольких гидроксогрупп.
- 3. Состав оснований: Назовите составные части оснований. Ме(ОН)х Валентность гидроксогруппы (ОН) – I Количество гидроксогрупп определяется валентностью
- 4. Основания NaOH – гидроксид натрия Ca(OH)2 – гидроксид кальция Fe(OH)3 – гидроксид железа (III) Cи(OH)2 –
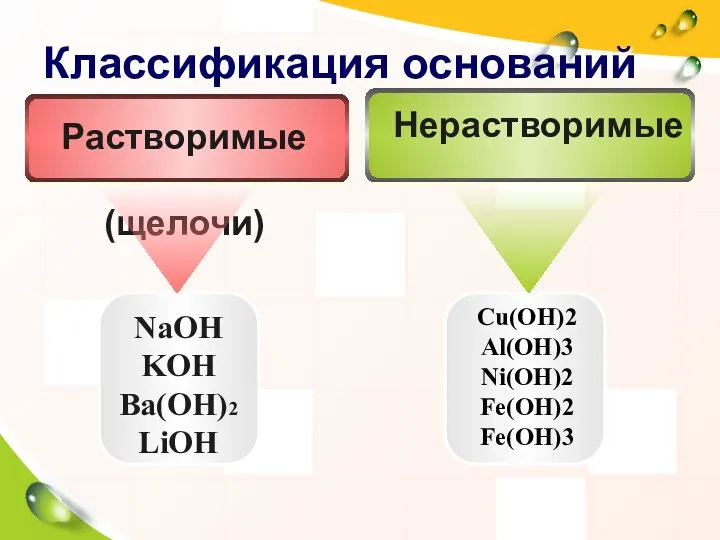
- 5. Классификация оснований NaOH KOH Ba(OH)2 LiOH Cu(OH)2 Al(OH)3 Ni(OH)2 Fe(OH)2 Fe(OH)3 Нерастворимые Растворимые (щелочи)
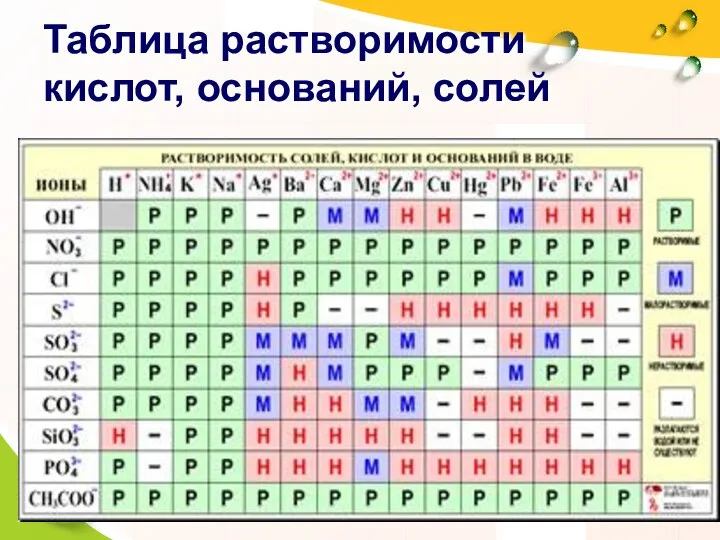
- 6. Таблица растворимости кислот, оснований, солей
- 7. Однокислотные NaOH, KOH Двухкислотные Pb(OH)2, Fe(OH)2 Трехкислотные Al(OH)3 Классификация оснований по числу гидроксогрупп. Основания
- 8. Физические свойства оснований Агрегатное состояние: Все твердые вещества Цвет : Белого – КОН, Голубого - Cu(OH)2
- 9. Химические свойства нерастворимых оснований. 1). Разлагаются при нагревании. 2). Взаимодействуют с кислотами (реакция нейтрализации).
- 10. 1. Термическое разложение нерастворимых оснований: Химические свойства оснований: t t
- 11. 2. Основание + кислота: Химические свойства оснований: Реакция нейтрализации – это…
- 12. Химические свойства щелочей. 1). Изменяют окраску индикаторов. Взаимодействуют с: 2). кислотами (реакция нейтрализации), 3). кислотными оксидами,
- 13. ПРАВИЛА БЕЗОПАСНОСТИ Едкое вещество—щелочь! Разрушает и раздражает кожу, слизистые оболочки. Попавшие на кожу капли раствора щелочи
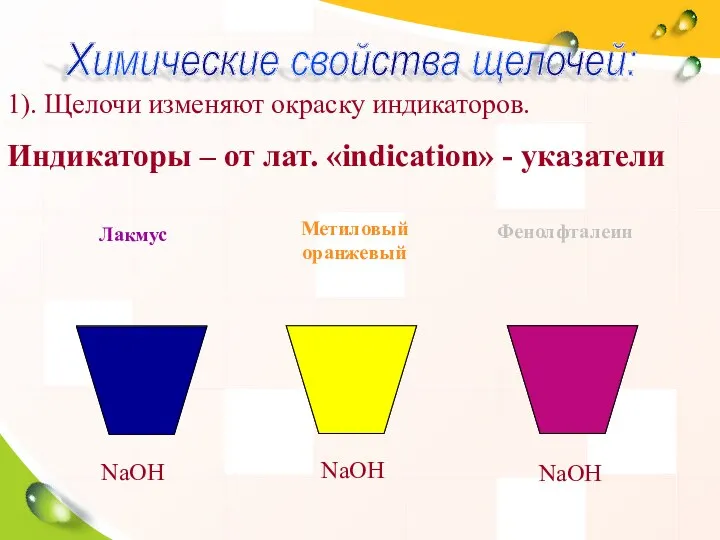
- 14. 1). Щелочи изменяют окраску индикаторов. Индикаторы – от лат. «indication» - указатели NaOH NaOH NaOH Лакмус
- 15. Щелочь + кислота : Ва(ОН)2 + 2НСl = ВаСl2 + 2Н2О хлорид бария Химические свойства щелочей:
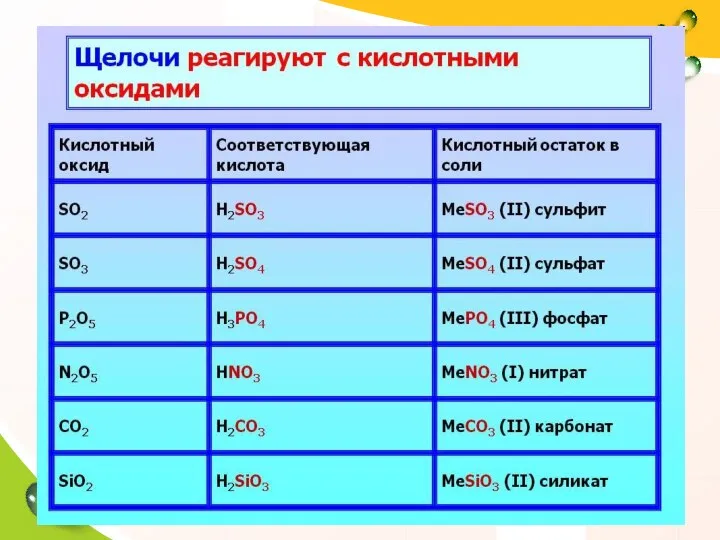
- 16. 3. Щелочь + кислотный оксид: Химические свойства щелочей: ! В ходе реакции образуется соль и вода
- 19. Скачать презентацию












 Превращение веществ. Роль химии в жизни человека
Превращение веществ. Роль химии в жизни человека Природные каменные материалы. (Лекция 3)
Природные каменные материалы. (Лекция 3) Химия өнеркәсібі
Химия өнеркәсібі Алкандар. (қаныққан көмірсутектер. Парафиндер.)
Алкандар. (қаныққан көмірсутектер. Парафиндер.) Электролитическая диссоциация
Электролитическая диссоциация Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Сутектік көрсеткіш ph. Тұздар гидролизі
Сутектік көрсеткіш ph. Тұздар гидролизі Основания. Формула сильной кислоты
Основания. Формула сильной кислоты Минералы
Минералы Природные источники углеводородов
Природные источники углеводородов Молярный объем газов
Молярный объем газов Визитка химического элемента. Водород
Визитка химического элемента. Водород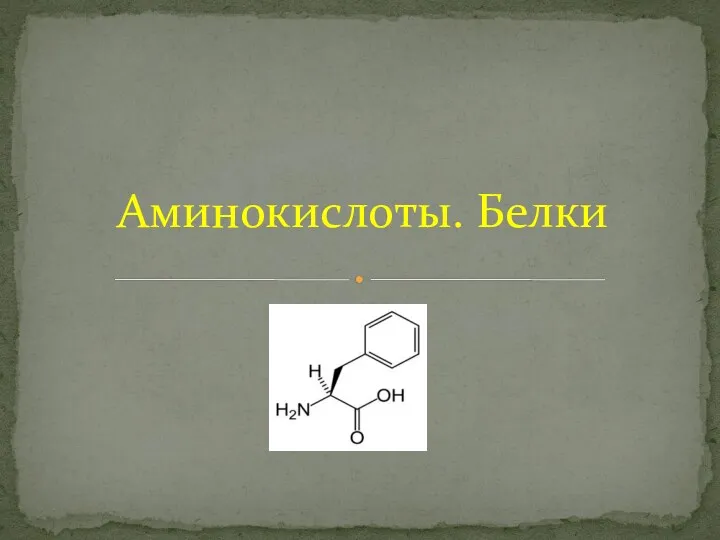 Аминокислоты. Белки
Аминокислоты. Белки Неметаллы. Особенности строения атомов неметаллов
Неметаллы. Особенности строения атомов неметаллов Многоатомные спирты
Многоатомные спирты Типы химических реакций в органической химии
Типы химических реакций в органической химии Коррозия и методы борьбы с ней
Коррозия и методы борьбы с ней Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Физические, химические свойства предельных и непредельных карбоновых кислот, получение Неметаллические и композиционные материалы
Неметаллические и композиционные материалы Кислород. Распространение кислорода в природе (8 класс)
Кислород. Распространение кислорода в природе (8 класс) Вклад ученых-химиков в победу в Великой Отечественной войне
Вклад ученых-химиков в победу в Великой Отечественной войне Нанотехнологии и Наноматериалы
Нанотехнологии и Наноматериалы Коррозия металлов и способы защиты от неё. (11 класс)
Коррозия металлов и способы защиты от неё. (11 класс) Химический процесс. Практические занятия
Химический процесс. Практические занятия Стехиометрия и классификация твердых веществ
Стехиометрия и классификация твердых веществ Общая характеристика твердого, жидкого и газообразного видов топлива
Общая характеристика твердого, жидкого и газообразного видов топлива Тайна мыльного пузыря
Тайна мыльного пузыря Алюминий и его соединения
Алюминий и его соединения