Содержание
- 4. РАСПРОСТРАНЕНИЕ КИСЛОРОДА В ПРИРОДЕ Первое место по распространенности в земной коре, т.е. литосфере, занимает кислород 49%
- 5. В биосфере около 65% от массы живых организмов приходится на кислород (входит в состав белков, жиров
- 6. В гидросфере на его долю приходится 89%.
- 7. Простое вещество кислород
- 8. В атмосфере 23% по массе и 21% по объему.
- 9. Молекулярный состав воздуха
- 10. Кислород может существовать в виде двух аллотропных модификаций - кислорода (О2) и озона (О3) Аллотропия (от
- 11. ЗО2 = 2О3
- 12. Сравнение свойств кислорода и озона
- 13. Первые сведения найдены в Европе из китайских рукописей 8 в; В начале 16 в. Леонардо да
- 14. Кислород был открыт английским химиком Джозефом Пристли 1 августа 1774 года путём разложения оксида ртути в
- 15. О своём открытии Пристли сообщил выдающемуся французскому химику Антуану Лавуазье. В 1775 году А. Лавуазье установил,
- 16. Несколькими годами ранее (в 1771 году) кислород получил шведский химик Карл Шееле. Он прокаливал селитру с
- 17. Получение кислорода в промышленности В промышленности кислород получают из воздуха. Воздух представляет собой смесь различных газов,
- 18. Жидкий кислород Газообразный кислород
- 19. Получение кислорода в лаборатории В лаборатории кислород получают из кислородсодержащих веществ путем их разложения при нагревании
- 20. При разложении пероксида водорода используют катализатор (MnO2) 2H2O2 =кат 2H2O + O2↑ Катализа́тор — химическое вещество,
- 21. Метод вытеснения воды Метод вытеснения воздуха (плохо растворяется в воде) (тяжелее воздуха М(возд) = 29г/моль)
- 22. Химические свойства кислорода (взаимодействие с простыми и сложными веществами)
- 23. Взаимодействие кислорода с простыми веществами Взаимодействие с неметаллами (образуются оксиды неметаллов или кислотные оксиды) 2Н2 +
- 24. Взаимодействие кислорода со сложными веществами (образуются оксиды) Взаимодействие с неорганическими веществами: 2H2S + 3O2 = 2SO2
- 25. Характерной особенностью многих реакций соединения с кислородом является выделение теплоты и света. Такие реакции называются горением
- 26. Биологическая роль кислорода Большинство живых существ (аэробы) дышат кислородом воздуха. Широко используется кислород в медицине. При
- 27. Круговорот кислорода
- 28. ПРИМЕНЕНИЕ КИСЛОРОДА ЧЕЛОВЕКОМ
- 30. Скачать презентацию
 Кислородсодержащие соединения серы
Кислородсодержащие соединения серы Формирование ключевых компетенций на уроках химии
Формирование ключевых компетенций на уроках химии Обмен кетоновых тел, фосфолипидов, особенности обмена липидов в органах и тканях
Обмен кетоновых тел, фосфолипидов, особенности обмена липидов в органах и тканях Классификация химических реакций
Классификация химических реакций Химическая посуда
Химическая посуда Водород. Распространенность в природе
Водород. Распространенность в природе Хімічні властивості насичених одноатомних спиртів. Одержання етанолу
Хімічні властивості насичених одноатомних спиртів. Одержання етанолу Органическая химия
Органическая химия Жидкостная хроматография
Жидкостная хроматография Оксиды, свойства и способы получения
Оксиды, свойства и способы получения Газы, применяемые при сварке
Газы, применяемые при сварке Задачи на массовую долю растворённого вещества в растворе
Задачи на массовую долю растворённого вещества в растворе Сложные эфиры. Жиры. Мыло
Сложные эфиры. Жиры. Мыло Соли в свете теории электролитической диссоциации
Соли в свете теории электролитической диссоциации Высокомолекулярные соединения и супрамолекулярные структуры. Синтез полимеров (Лекция 1)
Высокомолекулярные соединения и супрамолекулярные структуры. Синтез полимеров (Лекция 1) Циклоалканы. Предельные углеводороды с замкнутой (циклической) углеродной цепью
Циклоалканы. Предельные углеводороды с замкнутой (циклической) углеродной цепью Озоновый слой. Механизмы образования и разрушения
Озоновый слой. Механизмы образования и разрушения Понятие о спиртах. 9 класс
Понятие о спиртах. 9 класс Алкины. Ацетилен.
Алкины. Ацетилен.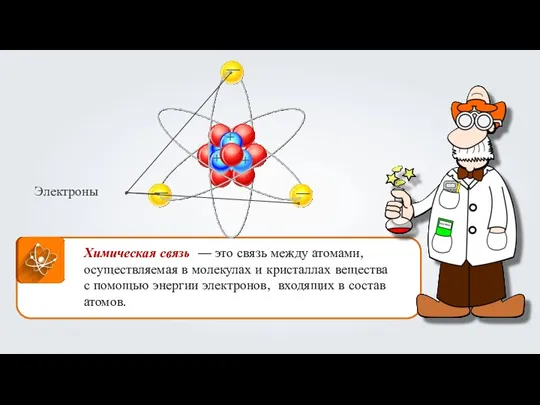 Химическая связь
Химическая связь Углеводороды. Арены (ароматические углеводороды)
Углеводороды. Арены (ароматические углеводороды) Алкины (ацетиленовые углеводороды)
Алкины (ацетиленовые углеводороды) Электронные представления в химии
Электронные представления в химии Серная кислота H2SO4
Серная кислота H2SO4 Эквивалент. Лекция 1
Эквивалент. Лекция 1 Химическая связь
Химическая связь Получение и собирание газов. Практическая работа
Получение и собирание газов. Практическая работа Классификация химических реакций
Классификация химических реакций