Содержание
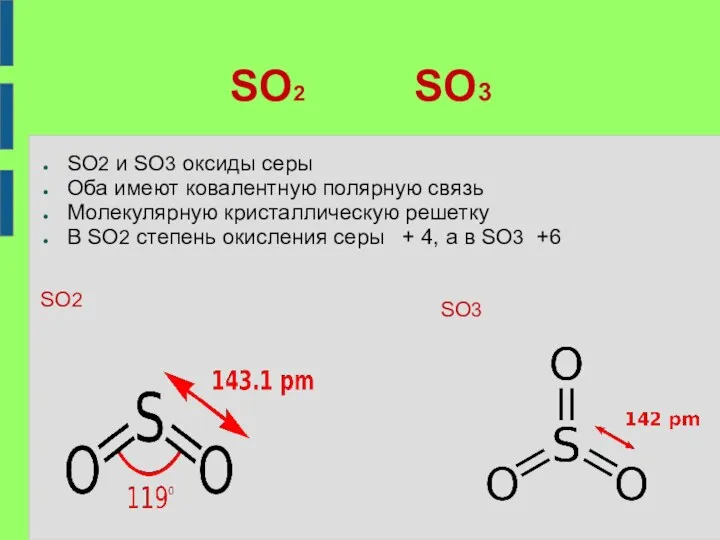
- 2. SO2 SO3 SO2 и SO3 оксиды серы Оба имеют ковалентную полярную связь Молекулярную кристаллическую решетку В
- 3. SO2 физические свойства Оксид серы IV, диоксид серы, сернистый газ Бесцветный газ с характерным резким запахом
- 4. SO3 физические свойства Оксид серы VI, триоксид серы Легколетучая бесцветная маслянистая жидкость с удушающим запахом При
- 5. SO2 получения Промышленный способ получения — сжигание серы или обжиг сульфидов, в основном — пирита: 4FeS2+11O2→2Fe2O3+8SO2
- 6. SO3 получения Получают, окисляя оксид серы (IV) кислородом воздуха при нагревании, в присутствии катализатора V2O5, реакция
- 7. SO2 химические свойства SO2 реагирует с: Водой Основными оксидами Co Щелочами SO2+H2O=H2SO3 SO2+Na2O=Na2SO3 SO2+2NaOH=Na2SO3+H2O
- 8. Химическая активность SO2 весьма велика. Наиболее ярко выражены восстановительные свойства SO2 + 2HNO3 → H2SO4+ 2NO2
- 9. SO3 химические свойства Основными оксидами SO3+Na2O = Na2SO4 Водой SO2+H2O=H2SO4 Основаниями 2KOH+SO3→K2SO4+H2O SO3 растворяется в H2SO4+SO3→H2S2O7
- 10. SO2 применения Для производства серной кислоты В качестве консерванта (пищевая добавка E220) в вине Так как
- 11. SO3 применения Для получения серной кислоты
- 12. Кислородсодержащие кислоты и соли серы H2SO3 сернистая неустойчивая кислота H2SO4 серная кислота CuSO4*5H2O-медный купорос FeSO4*7H2O-железный купорос
- 13. Физические свойства H2SO4 - тяжелая маслянистая жидкость ("купоросное масло"), - хорошо растворима в воде – с
- 14. Химические свойства Индикатор -лакмус (красный) -метилоранж (красный) -фенолфталеин (б/ц) С основными и амфотерными оксидами CuO +
- 15. Взаимодействие с металлами С щелочными и щелочноземельными металлами 8Na +5 H2SO4(конц) → 4Na2SO4 + H2S +
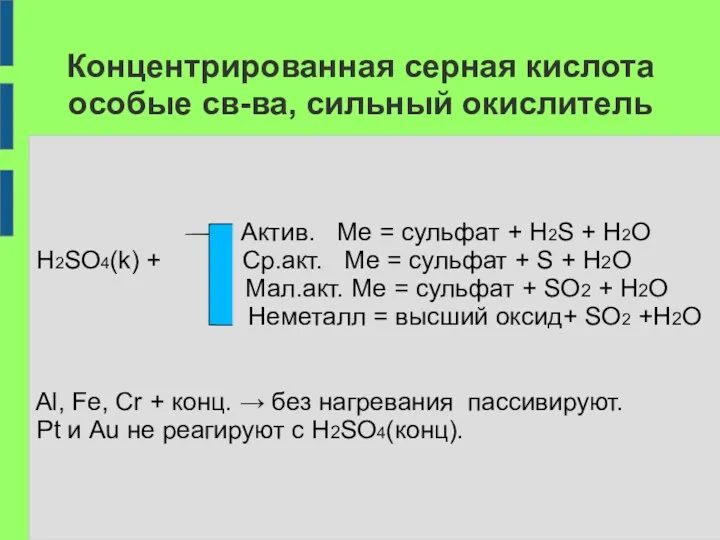
- 16. Концентрированная серная кислота особые св-ва, сильный окислитель Актив. Ме = сульфат + H2S + H2O H2SO4(k)
- 17. С неметаллами 2P + 5H2SO4(конц) → 5SO2 + 2H3PO4 + 2Н2О С + 2H2SO4(конц) → CO2
- 18. ПОСЛЕДНИЙ САМЫЙ ВАЖНЫЙ ВОПРОС
- 19. Это я если оценка 2
- 20. Это я если 5
- 22. Скачать презентацию

















 Аммиак. Строение, свойства, получение, применение
Аммиак. Строение, свойства, получение, применение Химиялық элемент оттегі
Химиялық элемент оттегі Переработка газа. Первичная переработка нефти. Лекция 9
Переработка газа. Первичная переработка нефти. Лекция 9 Дефекты в твердых телах
Дефекты в твердых телах Методы исследования гидрохимического режима водоемов
Методы исследования гидрохимического режима водоемов Растворы. Способы выражения концентрации растворенного вещества
Растворы. Способы выражения концентрации растворенного вещества Альдегіди. Будова молекул
Альдегіди. Будова молекул Учение об агрегатных состояниях вещества. Газообразное состояние
Учение об агрегатных состояниях вещества. Газообразное состояние Механизм реакции в органической химии
Механизм реакции в органической химии Xимия. Cr, Cu, Fe, Zn
Xимия. Cr, Cu, Fe, Zn Исследовательский проект определение качества питьевой воды в домашних условиях
Исследовательский проект определение качества питьевой воды в домашних условиях Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Карбоновые кислоты – союз двух групп (урок-исследование химических свойств карбоновых кислот)
Карбоновые кислоты – союз двух групп (урок-исследование химических свойств карбоновых кислот) В мире криссталлов
В мире криссталлов Көмірсутектер.Олардың жіктелуі, құрылысы,изомериясы және номенклатурасы
Көмірсутектер.Олардың жіктелуі, құрылысы,изомериясы және номенклатурасы Теплова теорія припинення горіння. Вогнегасні засоби
Теплова теорія припинення горіння. Вогнегасні засоби Углеводы. (Лекция 7)
Углеводы. (Лекция 7) Щелочные металлы и их соединения. 9 класс
Щелочные металлы и их соединения. 9 класс Железо и его сплавы
Железо и его сплавы Обзор свойств неметаллов.. Окислительно-восстановительные свойства типичных неметаллов
Обзор свойств неметаллов.. Окислительно-восстановительные свойства типичных неметаллов Задачи и методы количественного анализа. Кислотно-основное титрование
Задачи и методы количественного анализа. Кислотно-основное титрование Вирощення кристталів
Вирощення кристталів Игра-квест на уроке химии
Игра-квест на уроке химии Кислород. Открытие кислорода
Кислород. Открытие кислорода Жесткость воды и способы её устранения
Жесткость воды и способы её устранения Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Отримання нанопорошків. Класифікація. Фізичні методи отримання нанопорошків. . Хімічні методи отримання наноматеріалів
Отримання нанопорошків. Класифікація. Фізичні методи отримання нанопорошків. . Хімічні методи отримання наноматеріалів Строение атома. Периодический закон и система элементов Д.И. Менделеева. Химическая связь. Гибридизация
Строение атома. Периодический закон и система элементов Д.И. Менделеева. Химическая связь. Гибридизация