Содержание
- 2. Вирощування кристалів- дуже цікавий процес, що потребує терпіння, охайності, наполегливості. Речовини для дослідів з кристалами Алюмокалієві
- 3. Найпростіше вирощувати кристали з водних розчинів, але не всі з них придатні для вирощування. Важко, наприклад,
- 4. Методика вирощування водорозчинних кристалів Для вирощування кристалів можна застосувати два методи. Першим методом ми виростимо початковий
- 5. Суть другого методу у повільному випаровуванні води з холодного розчину. У певній кількості води можна розчинити
- 6. Так закріплюємо кристалик-затравку Нитка, на якій ріс кристал, залишається "замурованою" в ньому!
- 7. Алюмо-калієві галуни Природні галуни - це мінерали, подвійні водні сульфати алюмінію (найчастіше) і лужних катіонів.Загальна формула
- 8. Дихромат калію Дихромат калію – K2Cr2O7. Добре розчинний у воді. Застосовується при виробництві барвників, при дубленні
- 9. Калій Гексаціаноферат (III) Комплексна сполука тривалентного Феруму K3(Fe(CN)6). В 1822 німецьким хіміком Леопольдом Гмеліном сполуку було
- 10. Кристали хлорида міді (ІІ) ( купрум(ІІ) хлориду) Через 2 дні після закладки досліду День четвертий День
- 12. Скачать презентацию
Вирощування кристалів- дуже цікавий процес, що потребує терпіння, охайності, наполегливості.
Речовини для
Вирощування кристалів- дуже цікавий процес, що потребує терпіння, охайності, наполегливості.
Речовини для
Алюмокалієві галуни
Хромокалієві галуни
Купрум (ІІ) хлорид і мідний купорос
Найпростіше вирощувати кристали з водних розчинів, але не всі з них
Найпростіше вирощувати кристали з водних розчинів, але не всі з них
Але ж які доступні речовини можна використовувати для вирощування кристалів? В аптеках можна знайти алюмокалієві галуни. Галунами з давнини називають різноманітні солі сірчаної (сульфатної) кислоти, які мають два метали, один з яких зазвичай алюміній, хром або залізо, а другий калій, натрій та ін. Алюмокалієві галуни застосовують при фарбуванні тканин, при проклеюванні паперу. В медицині галуни застосовують як засіб для зупинки кровотечі та поглинання вологи.
Методика вирощування водорозчинних кристалів
Для вирощування кристалів можна застосувати два методи.
Першим
Методика вирощування водорозчинних кристалів
Для вирощування кристалів можна застосувати два методи.
Першим
Суть другого методу у повільному випаровуванні води з холодного розчину. У
Суть другого методу у повільному випаровуванні води з холодного розчину. У
Більшість кристалів, які ми вирощуємо – кристалогідрати, тобто мають у своєму складі хімічно зв’язану (кристалізаційну) воду. Кристалізаційна вода в кристалі зв’язана не дуже міцно, осі чому кристали з часом вивітрюються. І великі гарні правильні монокристали втрачають свій яскравий вигляд вже через два тижні. Але якщо вам дорогі ваші кристали, можна захиститися від вивітрювання. Покриття кристалів прозорим лаком або поміщення у спеціальні бюкси захистить кристали від вивітрювання.
Так закріплюємо кристалик-затравку
Нитка, на якій ріс кристал, залишається "замурованою" в ньому!
Так закріплюємо кристалик-затравку
Нитка, на якій ріс кристал, залишається "замурованою" в ньому!
Алюмо-калієві галуни
Природні галуни - це мінерали, подвійні водні сульфати алюмінію (найчастіше)
Алюмо-калієві галуни
Природні галуни - це мінерали, подвійні водні сульфати алюмінію (найчастіше)
Вирощуємо кристали галунів
Галуни, а як виглядають! Як справжні діаманти!
Монокристал галунів
Дихромат калію
Дихромат калію – K2Cr2O7. Добре розчинний у воді. Застосовується при виробництві
Дихромат калію
Дихромат калію – K2Cr2O7. Добре розчинний у воді. Застосовується при виробництві
Калій Гексаціаноферат (III)
Комплексна сполука тривалентного Феруму K3(Fe(CN)6). В 1822 німецьким хіміком Леопольдом Гмеліном сполуку
Калій Гексаціаноферат (III)
Комплексна сполука тривалентного Феруму K3(Fe(CN)6). В 1822 німецьким хіміком Леопольдом Гмеліном сполуку
Nota Bene! При взаємодії с кислотами виділяється циановодень (дуже отруйний):
K3(Fe(CN)6) + 6HCl = 3KCl + FeCl3 + 6HCN.
монокристал червоної кров'яної солі
Кристали хлорида міді (ІІ) ( купрум(ІІ) хлориду)
Через 2 дні після закладки
Кристали хлорида міді (ІІ) ( купрум(ІІ) хлориду)
Через 2 дні після закладки
День четвертий
День шостий
День восьмий









 Органолептические и визуальные методы идентификация полимера
Органолептические и визуальные методы идентификация полимера Көміртекті материалдар
Көміртекті материалдар Количественный учет влияния заместителя на реакционную способность и его использование для интерпретации механизмов реакций
Количественный учет влияния заместителя на реакционную способность и его использование для интерпретации механизмов реакций Валентность и степень окисления химического элемента
Валентность и степень окисления химического элемента Vitaminele
Vitaminele Амины. Классификация аминов. Характеристика метиламина и анилина
Амины. Классификация аминов. Характеристика метиламина и анилина Окисно-відновні реакції. Хімія. 9 клас
Окисно-відновні реакції. Хімія. 9 клас Явления, происходящие с веществами
Явления, происходящие с веществами Муравьиная кислота
Муравьиная кислота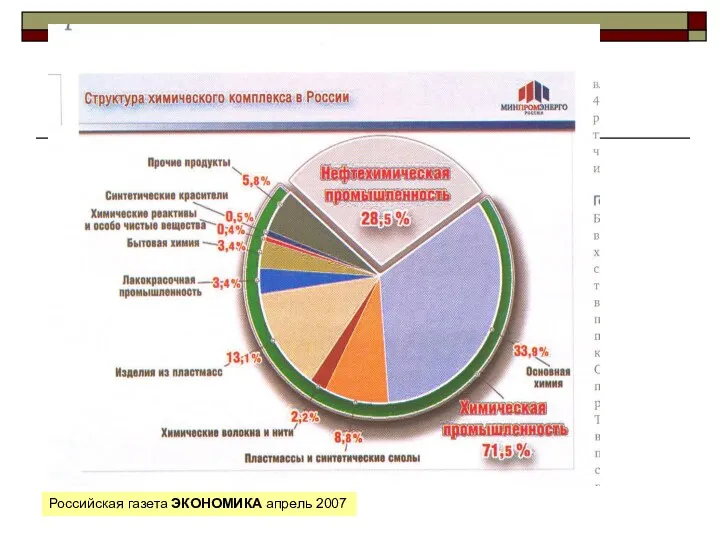 Свойства и классификация нефти
Свойства и классификация нефти Химические и физические свойства воды
Химические и физические свойства воды Полистирол өндірісі
Полистирол өндірісі Химический элемент и вещество
Химический элемент и вещество Природный газ
Природный газ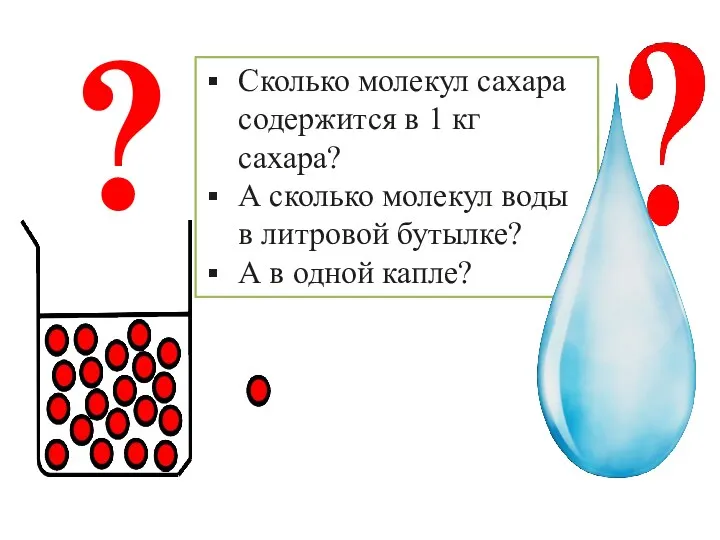 Количество вещества. 8 класс
Количество вещества. 8 класс Электролитическая диссоциация
Электролитическая диссоциация Неметаллы: общая характеристика. 9 класс
Неметаллы: общая характеристика. 9 класс Нитраты в овощах и фруктах
Нитраты в овощах и фруктах Кремний. Применение кремния
Кремний. Применение кремния Химические свойства металлов
Химические свойства металлов Методы анализа. Классификация методов анализа
Методы анализа. Классификация методов анализа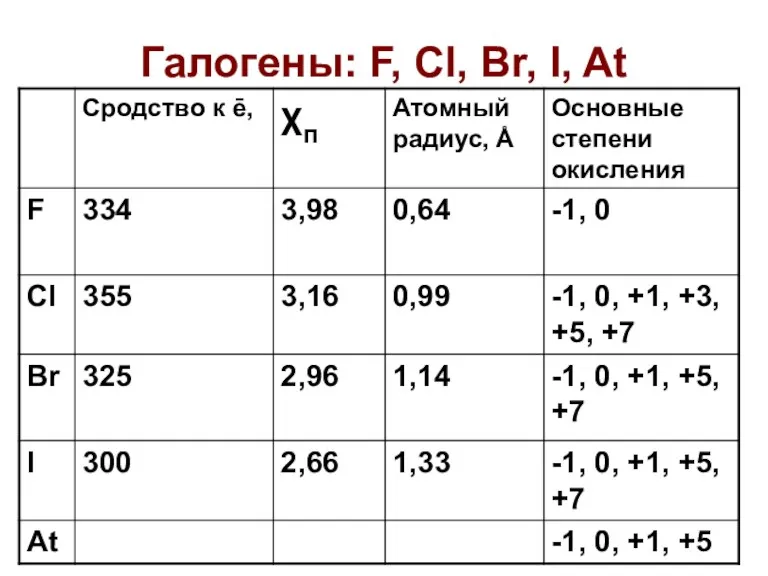 Галогены: F, Cl, Br, I, At
Галогены: F, Cl, Br, I, At Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Скорость химических реакций. Факторы, влияющие на скорость химической реакции (лекция № 5)
Скорость химических реакций. Факторы, влияющие на скорость химической реакции (лекция № 5) Интегрированный урок по химии и немецкому языку “Anwendung Hydrolyse von Wasser”
Интегрированный урок по химии и немецкому языку “Anwendung Hydrolyse von Wasser” Гидролиз. Классификация солей
Гидролиз. Классификация солей Бумажная и тонкослойная хроматография
Бумажная и тонкослойная хроматография Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование