Содержание
- 2. Распространенность в природе F> Cl >Br > I >> At (τ1/2 (210At) = 8,1 часа) CaF2
- 3. Открытие элементов F2 - открыт в 1886 г., Муассан (Франция) Cl2 - открыт в 1774 г.
- 4. Происхождение названий F – греческое фторос – разрушение, гибель Cl – греческое хлорос – желто-зеленый Br
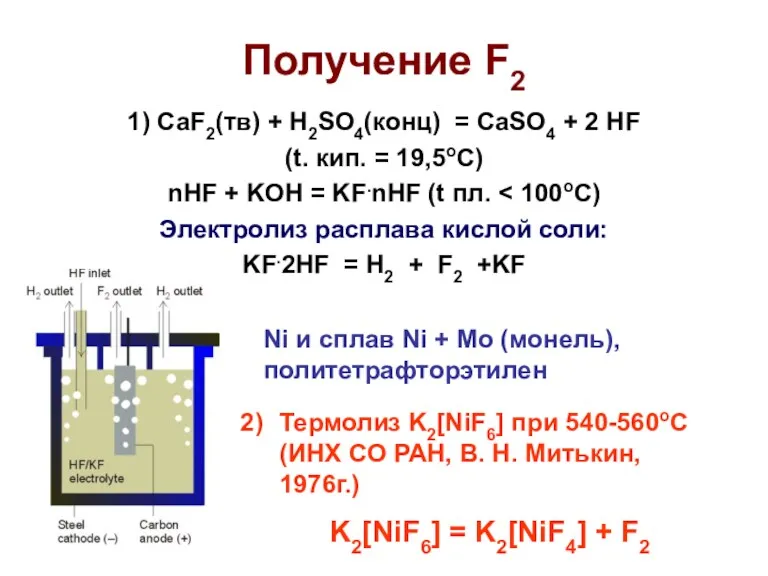
- 5. Получение F2 1) CaF2(тв) + H2SO4(конц) = CaSO4 + 2 HF (t. кип. = 19,5оС) nHF
- 6. Получение Cl2 NaCl (расплав) = Na + ½ Cl2 Анод: 2Cl- - 2ē = Cl2 Катод:
- 7. Лабораторные способы получения Cl2 Взаимодействие конц. HCl с разными окислителями: KMnO4, K2Cr2O7 (tºC) , MnO2 (tºC),
- 8. Получение Br2 Промышленный – хлорирование рассолов, содержащих Br- (морская вода и вода некоторых озер) 2Br- +
- 9. Получение I2 Лабораторный способ (редко) MnO2 + 2I- + 4H+ = Mn2+ +2H2O + I2 (возгоняют)
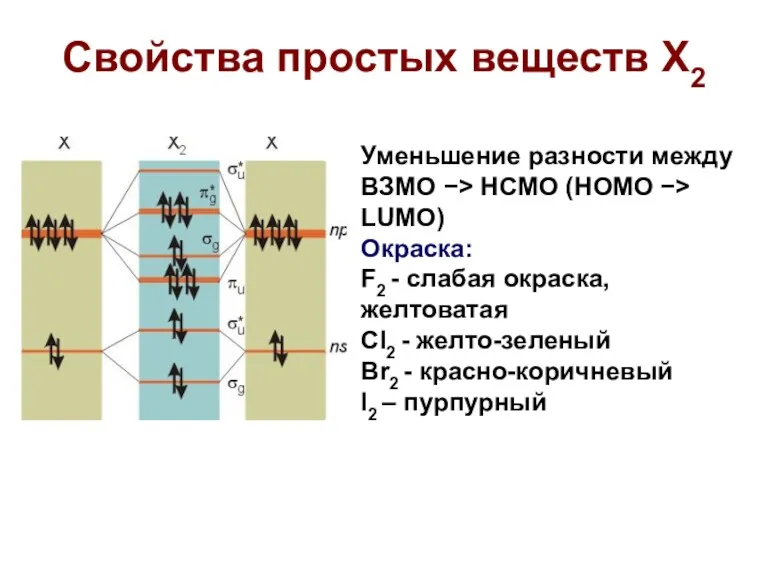
- 10. Свойства простых веществ X2 Уменьшение разности между ВЗМО −> НCМО (HOMO −> LUMO) Окраска: F2 -
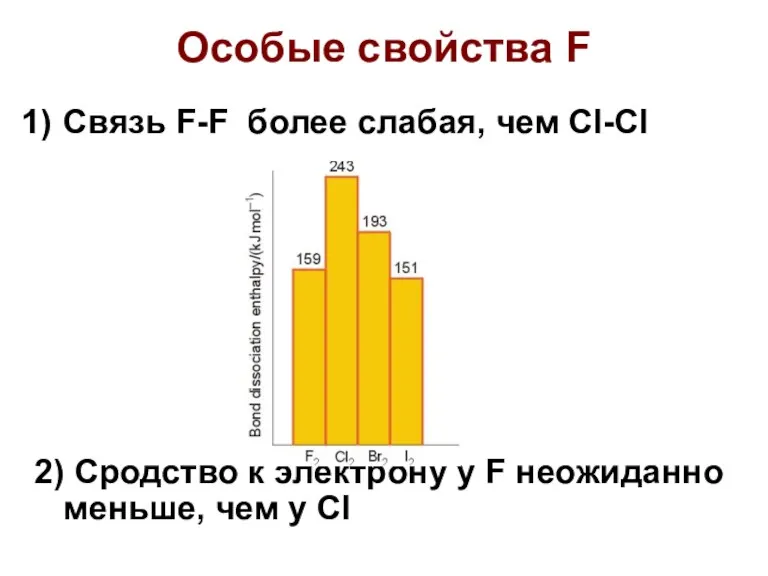
- 11. Особые свойства F Связь F-F более слабая, чем Cl-Cl 2) Сродство к электрону у F неожиданно
- 12. Особые свойства F 3) Соединения фтора более летучие, по сравнению с соединениями хлора t. кип. CF4
- 13. Особые свойства F 5) F – самый электроотрицательный элемент 6) По способности стабилизировать высшие степени окисления
- 14. Фторуглероды RH + 2CoF3 = RF + 2CoF2 + HF CoF3 регенерируют: 2CoF2 + F2 =
- 15. Галеноводороды НХ В газовой фазе: Hδ+→Xδ- (полярная ковалентная связь) Кислотность: HF > HCl > HBr >
- 16. Особенности HF HF (жидкая) – сильная кислота HF (газ) - сильная кислота HF (в воде) -
- 17. Ox/red свойства HX
- 18. Галогениды металлов – твердые в-ва, ионные кристаллы, как правило, растворимы в воде. Не растворимы в воде:
- 19. Получение HX А) Синтез из простых веществ H2 + X2 = 2 HX, ΔrH Для увеличения
- 20. Получение HX Б) Из солей реакцией ионного обмена CaF2(тв) + H2SO4 (конц) = CaSO4 + 2HF
- 21. Оксиды галогенов Неустойчивы, часто взрывают, с ними редко работают F: OF2, O2F2, F2O3(?), F2O4(?) Cl: Cl2O,
- 22. Оксиды фтора F2 + O2 – нет реакции при температурах 100-1000оС 2F2 + 2H2O = 4HF
- 23. Оксиды хлора: Cl2O Монооксид хлора Cl2O – желто-коричневый газ, при нагревании разлагается со взрывом. Ангидрид кислоты
- 24. Диокcид хлора ClO2 – желто-зеленый газ, парамагнитный (но не димеризуется!), термодинамически неустойчив (ΔfG = +121 кДж/моль).
- 25. Оксид хлора ClO2 Получение в промышленности 2NaClO3 + SO2 = 2NaHSO4 +2ClO2 (в 4 М H2SO4)
- 26. Оксид хлора Cl2O6 Оксид Cl2O6 – красная маслянистая жидкость, взрывает при соприкосновении с органикой При -70оС
- 27. Оксид хлора (VII), хлорный ангидрид Cl2O7 Бесцветная маслянистая жидкость, наиболее устойчив среди оксидов хлора, но взрывает
- 28. Оксиды брома Br2O – красно-коричневая жидкость, разлагается выше -40оС Получение HgO(тв) + Br2(г) = Br2O +
- 29. Оксиды брома BrO2 – желтое кристаллическое вещество, разлагается выше -40оС 2 BrO2 = Br2 + 2O2
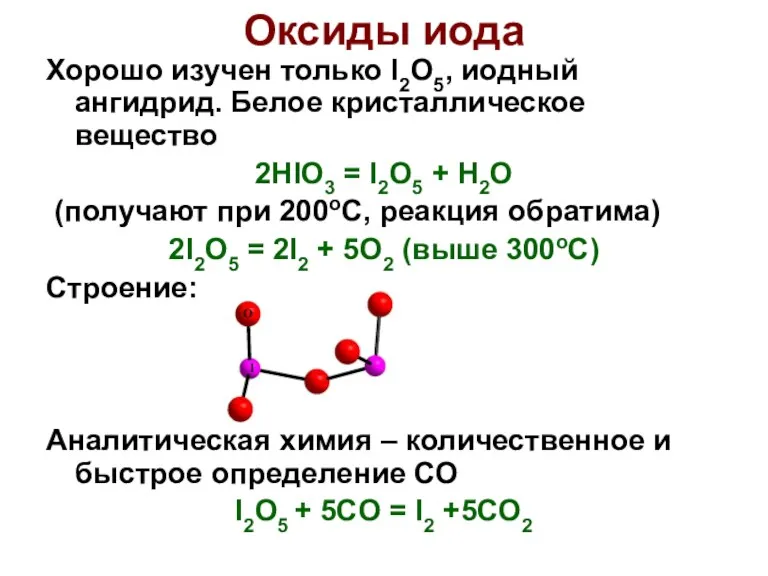
- 30. Хорошо изучен только I2O5, иодный ангидрид. Белое кристаллическое вещество 2HIO3 = I2O5 + H2O (получают при
- 31. Взаимодействие Х2 с водой Особенности F2 Физическое растворение и химические реакции. При низких температурах можно выделить
- 32. Химическое взаимодействие с водой X2 + H2O = H+ + X- + HOX Реакция диспропорционирования обратима.
- 33. Использование в промышленности «Жавелева» вода Cl2 + 2NaOH = NaCl + NaClO Отбеливание тканей, бумаги Хлорная
- 34. Диаграммы Латимера Показывают стандартные потенциалы ox/red процессов в виде схемы: степени окисления элемента уменьшаются слева на
- 35. Диаграммы Латимера для галогенов (рН = 14)
- 36. Диаграммы Латимера для галогенов (рН = 0)
- 37. Задача: рассчитать Ео для полуреакции в кислой среде: HClO + H+ + 2ē = Cl- +H2O
- 38. Диаграммы Латимера для галогенов (рН = 0)
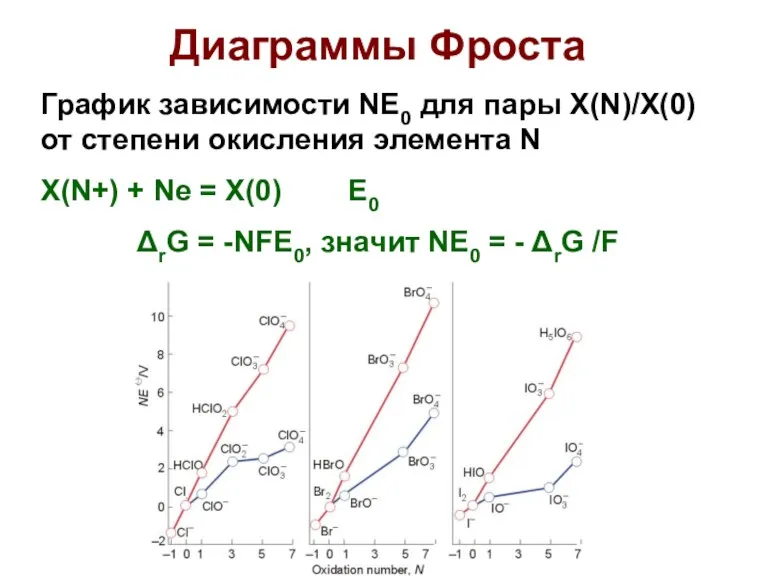
- 39. Диаграммы Фроста График зависимости NE0 для пары X(N)/X(0) от степени окисления элемента N X(N+) + Ne
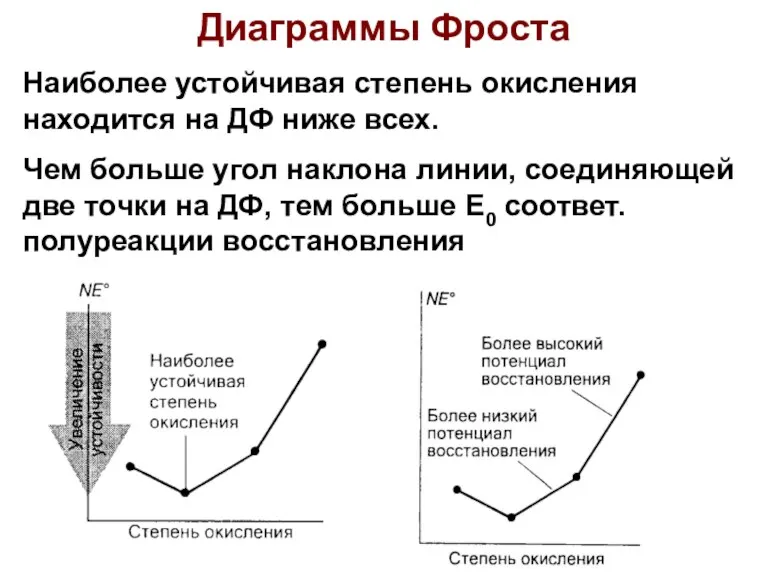
- 40. Диаграммы Фроста Наиболее устойчивая степень окисления находится на ДФ ниже всех. Чем больше угол наклона линии,
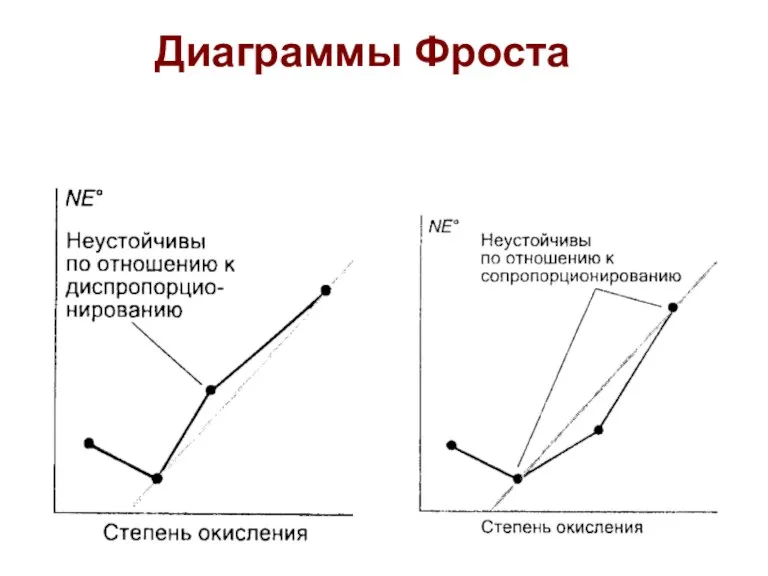
- 41. Диаграммы Фроста
- 42. Общие замечания по ДЛ и ДФ Ox/red реакции сильно зависят от рН и температуры. ДЛ и
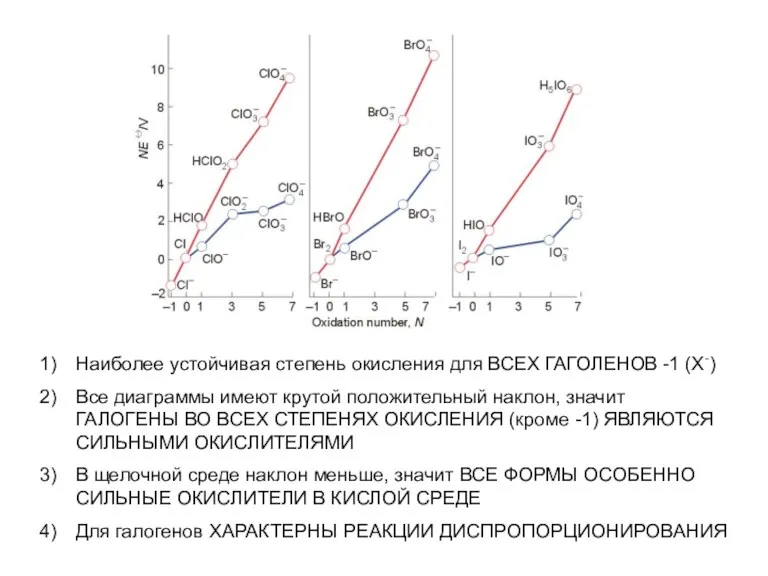
- 43. Наиболее устойчивая степень окисления для ВСЕХ ГАГОЛЕНОВ -1 (Х-) Все диаграммы имеют крутой положительный наклон, значит
- 44. Кислородсодержащие кислоты и их соли HXO: HFO(??), HClO, HBrO, HIO Ka = 10-8 (X = Cl),
- 45. Получение кислот HXO X2 + H2O + CaCO3 (тв) = CaCl2 + CO2 + HXO (X
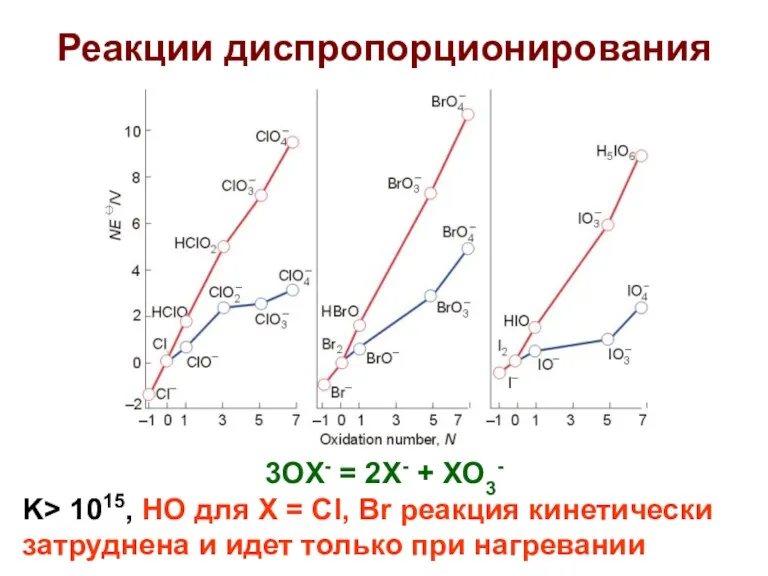
- 46. Реакции диспропорционирования 3OX- = 2X- + XO3- K> 1015, НО для X = Cl, Br реакция
- 47. Степень окисления +3 Нет HIO2 и нет примеров солей Нет HBrO2, только ОДИН пример соли Ba(BrO)2
- 48. Степень окисления +5 Сильные кислоты HXO3 (X = Cl, Br, I) HClO3 и HBrO3 – только
- 49. Получение соединений X(+5) ХЛОРАТЫ Электрохимическое окисление хлоридов KCl +3H2O = KClO3 (анод) + 3H2(катод) Или: 6KOH
- 50. Ox/red свойства X(+5) 1) Все X(+5)– сильные окислители 2) В кислой среде более сильные окислители, чем
- 51. Ox/red свойства X(+5) Все X(+5)– сильные окислители, как правило, восстанавливаются до X- KClO3(тв) + 6HCl (конц)
- 52. Разложение твердых солей при нагревании 4KClO3 = 3KClO4 + KCl (400oC) 2KClO3 = 2KCl + 3O2
- 53. Соединения Х(+7) HClO4 – получены 100% растворы (взрывоопасно!), сильная кислота HBrO4 – получены 100% растворы (взрывоопасно!),
- 54. Получение соединений X(+7) Электролиз XO3- + H2O = XO4-(анод) + H2(катод) Реакции в растворах KBrO3 +
- 55. Свойства соединений X(+7) ПЕРХЛОРАТЫ ВЗРЫВАЮТСЯ!!!!!!! KClO4(тв) = KCl + 2O2 (выше 500оС) 2NH4ClO4(тв) = N2 +
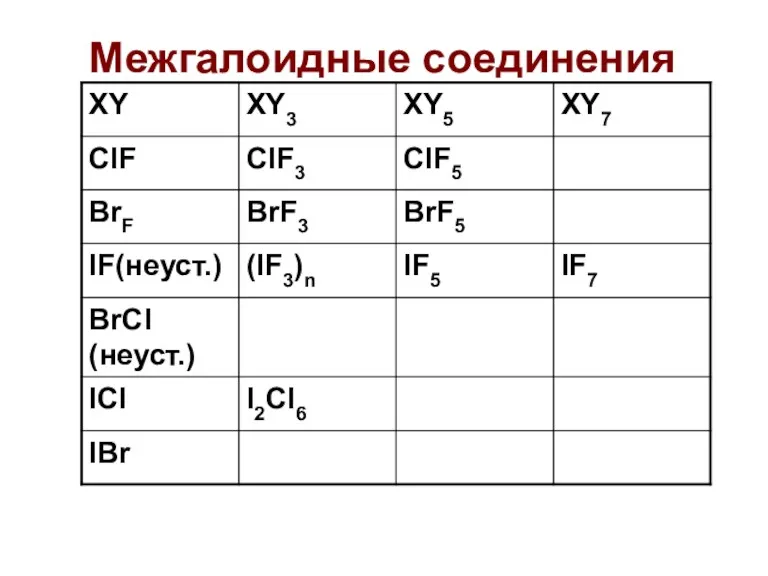
- 56. Межгалоидные соединения
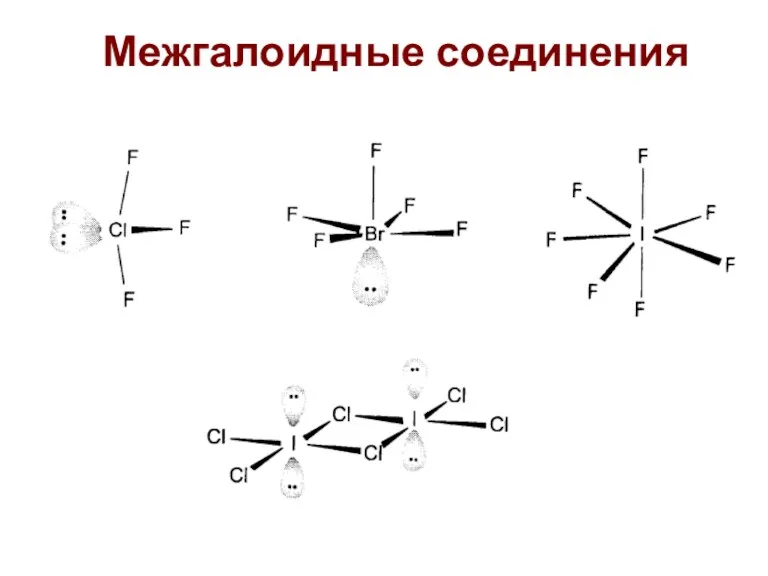
- 57. Межгалоидные соединения
- 58. Межгалоидные соединения Чаще всего используют ClF3 и BrF3 Окислители, бурно реагируют с органикой (взрыв), горит асбест,
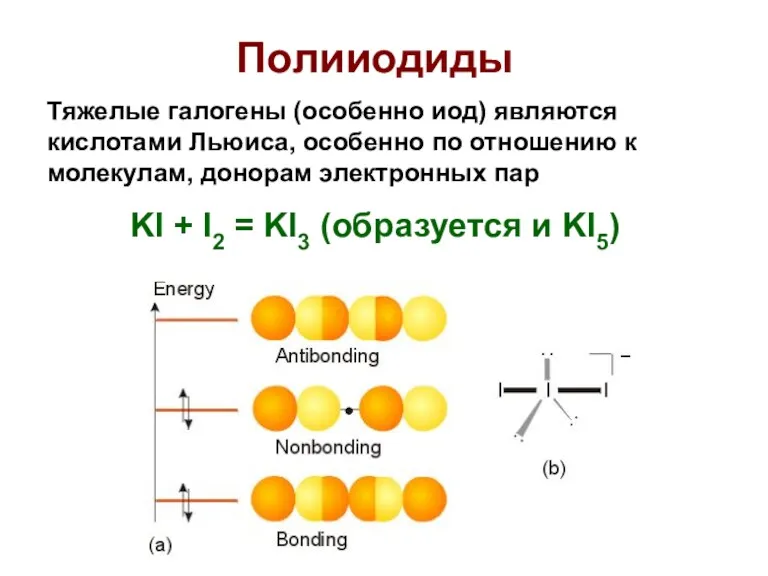
- 59. Полииодиды Тяжелые галогены (особенно иод) являются кислотами Льюиса, особенно по отношению к молекулам, донорам электронных пар
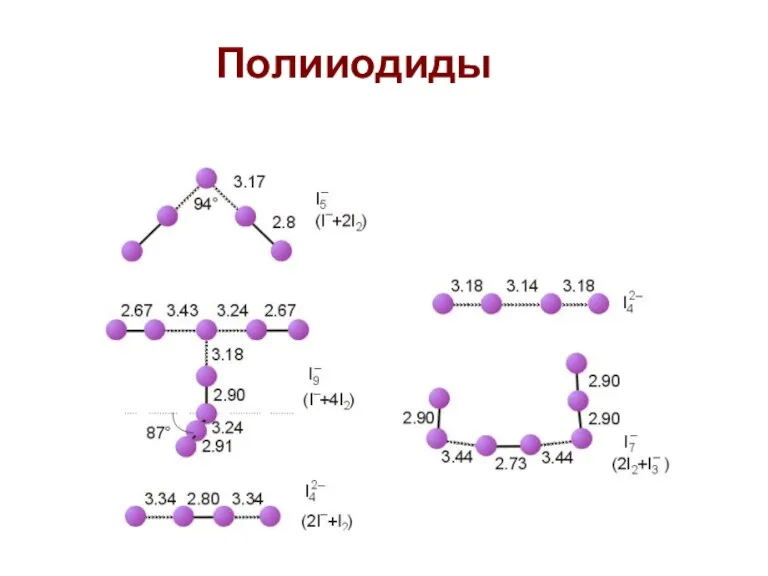
- 60. Полииодиды
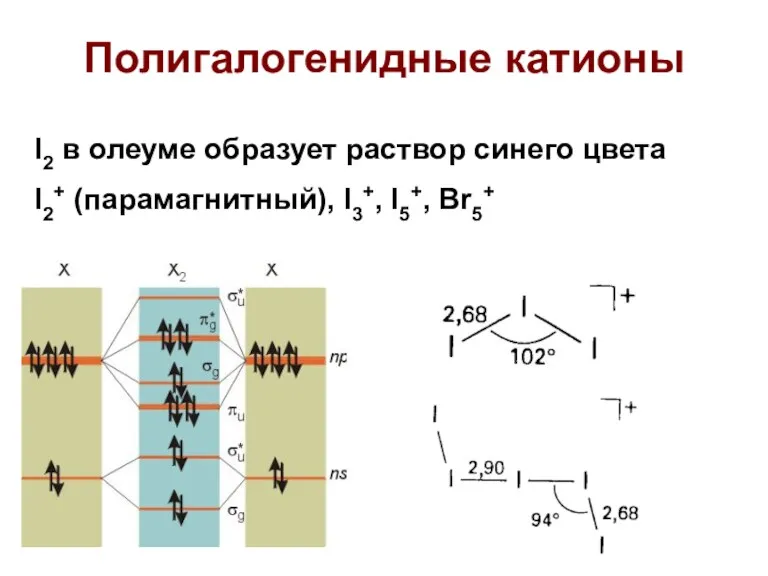
- 61. Полигалогенидные катионы I2 в олеуме образует раствор синего цвета I2+ (парамагнитный), I3+, I5+, Br5+
- 63. Скачать презентацию














































 Бензин. Производство бензина
Бензин. Производство бензина Types of chemical reactions
Types of chemical reactions соединения VI группы продвинутая версия
соединения VI группы продвинутая версия Азотсодержащие органические соединения
Азотсодержащие органические соединения Органическая химия. Лекция 13
Органическая химия. Лекция 13 Химическое равновесие. Смещение химического равновесия
Химическое равновесие. Смещение химического равновесия Современные положения теории А.М. Бутлерова
Современные положения теории А.М. Бутлерова Химические формулы. Относительная молекулярная масса
Химические формулы. Относительная молекулярная масса Изотопный обмен
Изотопный обмен Растворы. Вычисление массовой доли растворенного вещества в растворе. Урок для 8-го класса
Растворы. Вычисление массовой доли растворенного вещества в растворе. Урок для 8-го класса Коллоидная химия
Коллоидная химия Алкены. Этиленовые углеводороды, олефины
Алкены. Этиленовые углеводороды, олефины Nucleic acids
Nucleic acids Общая и медицинская химия
Общая и медицинская химия Создание косметических средств
Создание косметических средств Лекарственные средства из группы карбоновых кислот и их производных калия ацетат, кальция лактат, натрия цитрат
Лекарственные средства из группы карбоновых кислот и их производных калия ацетат, кальция лактат, натрия цитрат Алюминий и бор
Алюминий и бор Получение галогенов. Биологическое значение и применение галогенов и их соединений
Получение галогенов. Биологическое значение и применение галогенов и их соединений Титриметрический анализ. (Лекция 22)
Титриметрический анализ. (Лекция 22) проект по биологииНаучно-исследовательская работа
проект по биологииНаучно-исследовательская работа Аннелирование бензольного кольца
Аннелирование бензольного кольца Строение атома. Теории строения атома
Строение атома. Теории строения атома Анализ начальных участков изотерм адсорбции
Анализ начальных участков изотерм адсорбции Многоатомные спирты
Многоатомные спирты Щелочноземельные металлы. Химические свойства
Щелочноземельные металлы. Химические свойства Азот и его свойства
Азот и его свойства Нефть. Способы её переработки. Фракции нефти
Нефть. Способы её переработки. Фракции нефти Процесс электролиза
Процесс электролиза