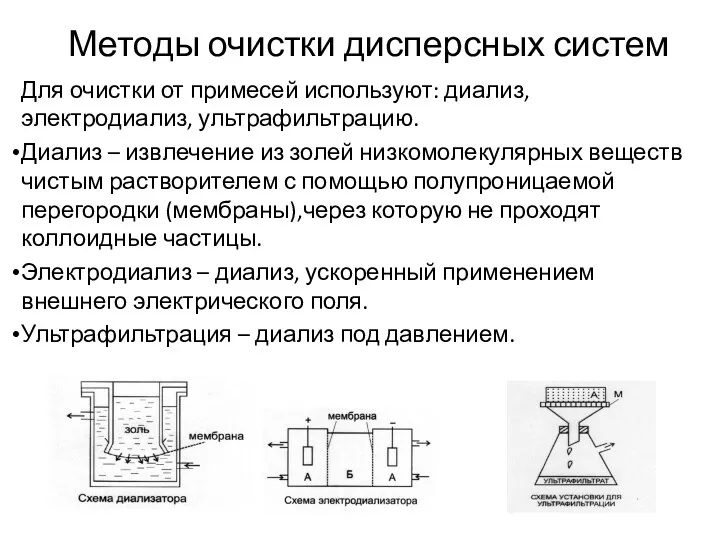
Конденсационные методы состоят во взаимодействии молекул истинных раствор с образованием частиц
коллоидных размеров, что может быть достигнуто как физическими, так и химическими методами.
Физические конденсационные методы:
Метод конденсации из паров- образование тумана в газовой фазе при понижении температуры. Пример: образование тумана, облаков, производство Н2SO4
Метод замены растворителя- раствор вещества приливают к жидкости, в которой это вещество практически не растворимо. Пример: Получение гидрозолей серы, холестерина, канифоли.
Химические конденсационные методы - методы основаны на образовании новой фазы (малорастворимого соединения) в результате протекания химических реакций. Любая химическая реакция, протекающая с образованием новой фазы, может быть источником получения коллоидной системы.
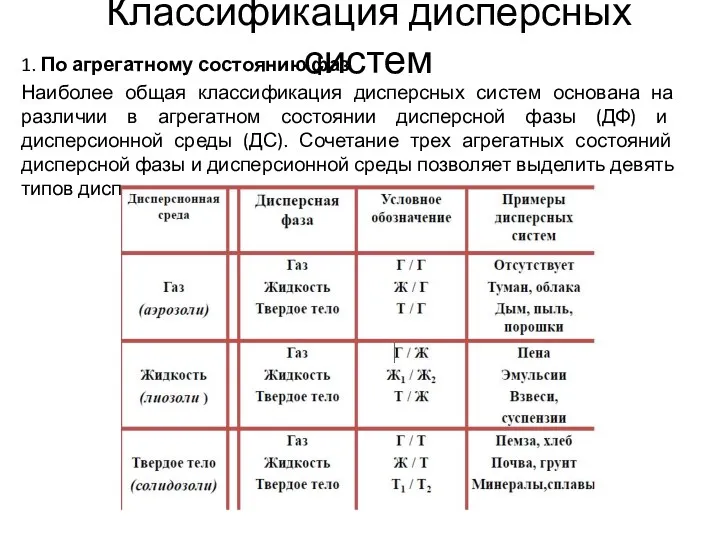
Методы получения дисперсных систем









 Химический элемент: йод
Химический элемент: йод Электролитическая диссоциация
Электролитическая диссоциация Галогены. Хлор
Галогены. Хлор Спирты и фенолы
Спирты и фенолы Азот
Азот Растворы. Часть 2
Растворы. Часть 2 Поливинилхлорид (ПВХ, PVC)
Поливинилхлорид (ПВХ, PVC) Металлы и сплавы с высокой удельной прочностью
Металлы и сплавы с высокой удельной прочностью Главная подгруппа IV группы. Общая характеристика элементов
Главная подгруппа IV группы. Общая характеристика элементов Арены. Бензол
Арены. Бензол Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы
Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы Совйства спиртов. 10 класс
Совйства спиртов. 10 класс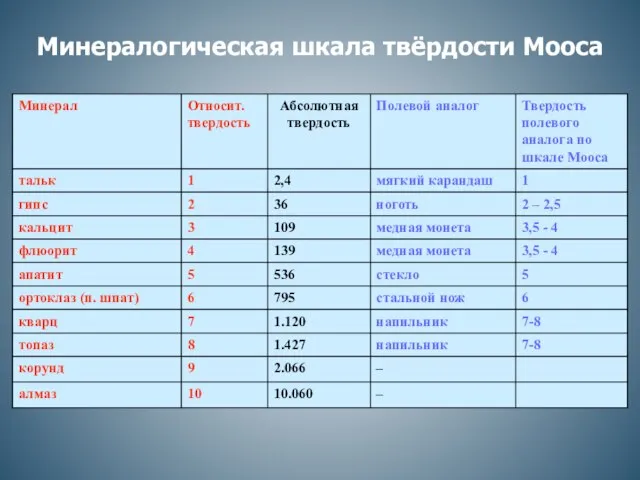 Минералогическая шкала твёрдости Мооса
Минералогическая шкала твёрдости Мооса Получение галогенов. Биологическое значение и применение галогенов и их соединений
Получение галогенов. Биологическое значение и применение галогенов и их соединений Азот, фосфор и их соединения
Азот, фосфор и их соединения Тепловой эффект химической реакции
Тепловой эффект химической реакции Окислительно-восстановительные реакции
Окислительно-восстановительные реакции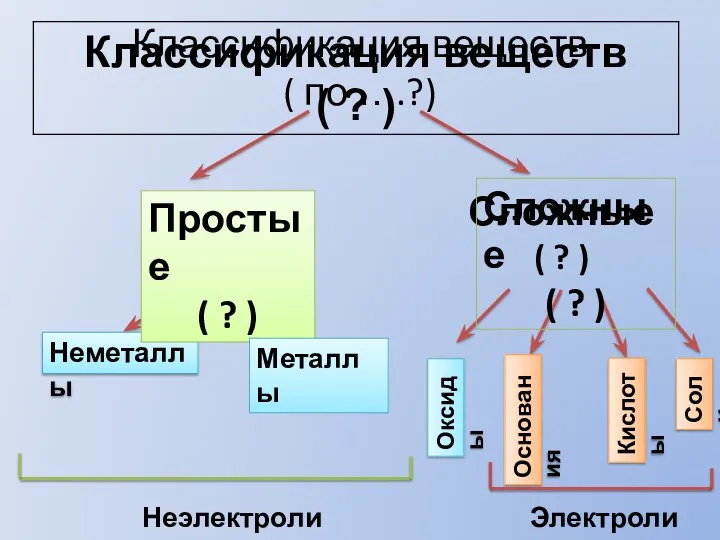 Классификация веществ
Классификация веществ Тефлон. Что такое тефлон?
Тефлон. Что такое тефлон? Нефтепродукты в косметическом производстве. Биологически активные вещества
Нефтепродукты в косметическом производстве. Биологически активные вещества Строение и физические свойства металлов
Строение и физические свойства металлов Неон. Физические свойства
Неон. Физические свойства Анализ проб воды
Анализ проб воды Наглядное пособие Динамические модели. Химическое равновесие в растворах
Наглядное пособие Динамические модели. Химическое равновесие в растворах Silicon. Silicate minerals. Weathering
Silicon. Silicate minerals. Weathering Химическая кинетика. Часть II. Скорость химической реакции - развитие реакции во времени
Химическая кинетика. Часть II. Скорость химической реакции - развитие реакции во времени Углерод
Углерод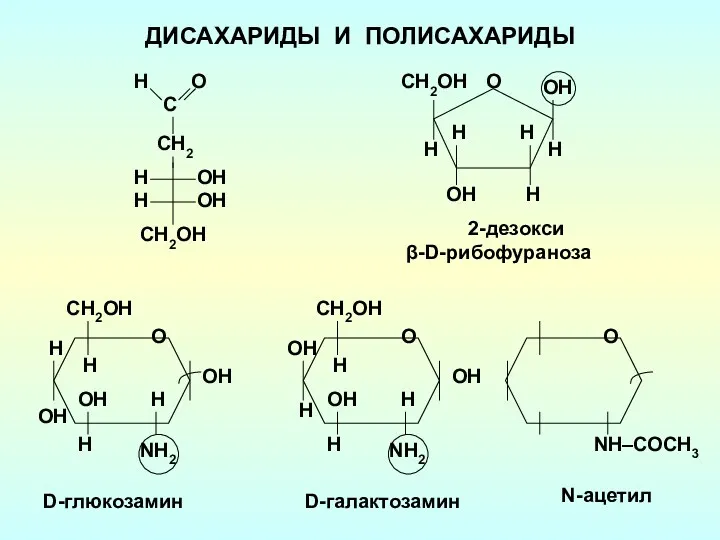 Дисахариды и полисахариды
Дисахариды и полисахариды