Содержание
- 2. Азот в природе. В природе может находится как в виде простого вещества, так и в соединениях.
- 3. Строение атома. В атоме 7 электронов, 7 протонов, 7 нейтронов. 7N:2е-, 5е- (незавершенный). Min степень окисления
- 4. При нормальных условиях – газ без цвета, вкуса, запаха, не ядовит, мало растворим в воде. Связь
- 5. Химические свойства азота. При нормальных условиях азот химически малоактивен. 1. Азот проявляет свойства окислителя (с элементами,
- 6. 2. Со сложными веществами азот практически не реагирует из-за крайне низкой реакционной способности. Взаимодействие возможно только
- 7. Способы получения азота 1. Азот в лаборатории получают при взаимодействии насыщенных растворов хлорида аммония и нитрита
- 8. Сборник задач: №383, №384.
- 10. Скачать презентацию
Слайд 2
Азот в природе.
В природе может находится как в виде простого
Азот в природе.
В природе может находится как в виде простого
вещества, так и в соединениях.
Наибольшая часть данного химического элемента находится в атмосфере в свободном состоянии. Он является главной составной частью воздуха. В связанном состоянии азот встречается повсеместно: в воздухе, водах рек, океанов и морей.
Азот является химическим элементом, необходимым для существования животных и растений, он входит в состав белков (16—18 % по массе), аминокислот, нуклеиновых кислот, нуклеопротеидов, хлорофилла, гемоглобина и др.
Наибольшая часть данного химического элемента находится в атмосфере в свободном состоянии. Он является главной составной частью воздуха. В связанном состоянии азот встречается повсеместно: в воздухе, водах рек, океанов и морей.
Азот является химическим элементом, необходимым для существования животных и растений, он входит в состав белков (16—18 % по массе), аминокислот, нуклеиновых кислот, нуклеопротеидов, хлорофилла, гемоглобина и др.
Слайд 3
Строение атома.
В атоме 7 электронов, 7 протонов, 7 нейтронов.
7N:2е-, 5е- (незавершенный).
Min
Строение атома.
В атоме 7 электронов, 7 протонов, 7 нейтронов.
7N:2е-, 5е- (незавершенный).
Min
степень окисления –3, max степень окисления +5.
В соединениях с водородом проявляет степень окисления –3: NH3.
Пример max степени окисления +5: HNO3.
В соединениях с водородом проявляет степень окисления –3: NH3.
Пример max степени окисления +5: HNO3.
Слайд 4
При нормальных условиях – газ без цвета, вкуса, запаха, не ядовит,
При нормальных условиях – газ без цвета, вкуса, запаха, не ядовит,
мало растворим в воде.
Связь – ковалентная неполярная.
Связь – ковалентная неполярная.
Строение и физические свойства простого вещества.
Слайд 5
Химические свойства азота.
При нормальных условиях азот химически малоактивен.
1. Азот проявляет свойства окислителя (с элементами, которые
Химические свойства азота.
При нормальных условиях азот химически малоактивен.
1. Азот проявляет свойства окислителя (с элементами, которые
расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому азот реагирует с металлами и неметаллами.
Молекулярный азот при обычных условиях с кислородом не реагирует. Реагирует с кислородом только при высокой температуре (2000оС), на электрической дуге (в природе – во время грозы):
N2 + O2 ⇄ 2NO
При сильном нагревании (3000оС-5000оС или действие электрического разряда) образуется атомарный азот, который реагирует с серой, фосфором, мышьяком, углеродом с образованием бинарных соединений:
2С + N2 → N≡C–C≡N
Молекулярный азот, таким образом, не реагирует с серой, фосфором, мышьяком, углеродом.
Азот взаимодействует с водородом при высоком давлении и высокой температуре, в присутствии катализатора. При этом образуется аммиак:
N2 + ЗН2 ⇄ 2NH3
Азот реагирует с активными металлами: с литием при комнатной температуре, кальцием, натрием и магнием при нагревании. При этом образуются бинарные соединения-нитриды. Например, литий реагирует с азотом с образованием нитрида лития:
N2 + 6Li → 2Li3N
Молекулярный азот при обычных условиях с кислородом не реагирует. Реагирует с кислородом только при высокой температуре (2000оС), на электрической дуге (в природе – во время грозы):
N2 + O2 ⇄ 2NO
При сильном нагревании (3000оС-5000оС или действие электрического разряда) образуется атомарный азот, который реагирует с серой, фосфором, мышьяком, углеродом с образованием бинарных соединений:
2С + N2 → N≡C–C≡N
Молекулярный азот, таким образом, не реагирует с серой, фосфором, мышьяком, углеродом.
Азот взаимодействует с водородом при высоком давлении и высокой температуре, в присутствии катализатора. При этом образуется аммиак:
N2 + ЗН2 ⇄ 2NH3
Азот реагирует с активными металлами: с литием при комнатной температуре, кальцием, натрием и магнием при нагревании. При этом образуются бинарные соединения-нитриды. Например, литий реагирует с азотом с образованием нитрида лития:
N2 + 6Li → 2Li3N
Слайд 6
2. Со сложными веществами азот практически не реагирует из-за крайне низкой реакционной способности.
2. Со сложными веществами азот практически не реагирует из-за крайне низкой реакционной способности.
Взаимодействие возможно только в жестких условиях с активными веществами, например, сильными восстановителями.
Например, азот окисляет гидрид лития:
N2 + 3LiH → Li3N + NH3
Например, азот окисляет гидрид лития:
N2 + 3LiH → Li3N + NH3
Химические свойства азота.
Слайд 7
Способы получения азота
1. Азот в лаборатории получают при взаимодействии насыщенных растворов хлорида аммония и
Способы получения азота
1. Азот в лаборатории получают при взаимодействии насыщенных растворов хлорида аммония и
нитрита натрия. Образующийся в результате реакции обмена нитрит аммония легко разлагается с образованием азота и воды. В колбу наливают раствор хлорида аммония, а капельную воронку раствор нитрита натрия. При приливании нитрита натрия в колбу начинается выделение азота. Собирают выделяющийся азот в цилиндр. Горящая лучинка в атмосфере азота гаснет.
NaNO2 + NH4Cl → NH4NO2 + NaCl
NH4NO2 → N2 + 2H2O
Суммарное уравнение процесса:
NaNO2 + NH4Cl → N2 + NaCl + 2H2O
Азот также образуется при горении аммиака:
4NH3 + 3O2 → 2N2 + 6H2O
2. Наиболее чистый азот получают разложением азидовщелочных металлов.
Например, разложением азида натрия:
2NaN3 → 2Na + 3N2
3. Еще один лабораторный способ получения азота — восстановление оксида меди (II) аммиаком при температуре ~700 °C:
3CuO + 2NH3 → 3Cu + N2 + 3H2O
В промышленности азот получают, буквально, из воздуха. При промышленном производстве очень важно, чтобы сырье было дешевым и доступным. Воздуха много и он пока бесплатный.
NaNO2 + NH4Cl → NH4NO2 + NaCl
NH4NO2 → N2 + 2H2O
Суммарное уравнение процесса:
NaNO2 + NH4Cl → N2 + NaCl + 2H2O
Азот также образуется при горении аммиака:
4NH3 + 3O2 → 2N2 + 6H2O
2. Наиболее чистый азот получают разложением азидовщелочных металлов.
Например, разложением азида натрия:
2NaN3 → 2Na + 3N2
3. Еще один лабораторный способ получения азота — восстановление оксида меди (II) аммиаком при температуре ~700 °C:
3CuO + 2NH3 → 3Cu + N2 + 3H2O
В промышленности азот получают, буквально, из воздуха. При промышленном производстве очень важно, чтобы сырье было дешевым и доступным. Воздуха много и он пока бесплатный.
Слайд 8
Сборник задач: №383, №384.
Сборник задач: №383, №384.
Следующая -
Трубчатые радиаторы Arbonia






 Углекислый газ СО2
Углекислый газ СО2 Методы хроматографии. Ионообменная хроматография
Методы хроматографии. Ионообменная хроматография Спирти
Спирти Енергетичний стан поверхні. Сорбційні явища. Мезопористі матеріали
Енергетичний стан поверхні. Сорбційні явища. Мезопористі матеріали Основи, їх склад, назви, класифікація
Основи, їх склад, назви, класифікація Зависят ли свойства предельных одноатомных спиртов от их химического строения?
Зависят ли свойства предельных одноатомных спиртов от их химического строения? Фосфор
Фосфор Кислород O2
Кислород O2 Жесткость воды
Жесткость воды Азотная кислота
Азотная кислота Всероссийская олимпиада школьников по химии (региональный этап). Разбор заданий, 9 класс
Всероссийская олимпиада школьников по химии (региональный этап). Разбор заданий, 9 класс Непредельные углеводороды: этилен
Непредельные углеводороды: этилен Поверхностно-активные вещества (ПАВ). Классификация ПАВ по степени влияния на окружающую среду
Поверхностно-активные вещества (ПАВ). Классификация ПАВ по степени влияния на окружающую среду Гниение. Брожение
Гниение. Брожение Теория кристаллического поля
Теория кристаллического поля Вещества и их свойства
Вещества и их свойства Азотные удобрения
Азотные удобрения Непредельные углеводороды
Непредельные углеводороды Теория электрической диссоциации
Теория электрической диссоциации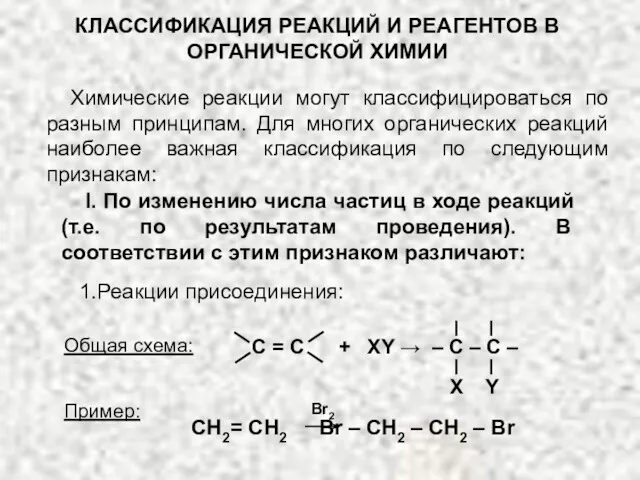 Классификация реакций и реагентов органической химии
Классификация реакций и реагентов органической химии Бор шикізатын қышқылдық ыдырату
Бор шикізатын қышқылдық ыдырату Органолептические и визуальные методы идентификация полимера
Органолептические и визуальные методы идентификация полимера Аминокислоты. Физические свойства
Аминокислоты. Физические свойства Введение в химическую технологию топлив и углеродных материалов
Введение в химическую технологию топлив и углеродных материалов Основания. Неорганические соединения
Основания. Неорганические соединения Положение в периодической системе Менделеева водорода, лантаноидов, актиноидов и искусственно полученных элементов
Положение в периодической системе Менделеева водорода, лантаноидов, актиноидов и искусственно полученных элементов Формы минералов и их агрегатов
Формы минералов и их агрегатов Основи. Властивості, застосування гідроксидів Натрію і Калію
Основи. Властивості, застосування гідроксидів Натрію і Калію