Содержание
- 2. Цели урока: -Выяснить зависимость физических и химических свойств спиртов от их строения. -Доказать физические и химические
- 3. Тест 1.Предельным одноатомным спиртам соответствует общая формула: (А13) 1)СnH2n+2 2)CnH2n+1OH 3)CnH2n-2 4)CnH2n+1COH
- 4. 2.Функциональной группе спиртов соответствует: (А14) 1)-OH 2)-СОН 3)-СООН 4)-O-
- 5. 3.Номенклатуре ИЮПАК соответствуют суффикс для предельных одноатомных спиртов: (А13) 1)-ил 2)-ол 3)-ен 4)-ан
- 6. 3.Формуле вещества соответствует название: (В1) CH3 I CH3 – CH – C – CH3 I I
- 7. 5.Сколько формул веществ изображено: (В1) а)CH3 – CH2 – CH2 – OH б) CH3 – CH
- 8. Проверь себя: 1.1 2.1 3.2 4.1 5.3
- 9. Физические свойства спиртов. C2H6O Реакция с натрием проходит Реакция с натрием не идет
- 10. Водородная связь в молекуле метанола:
- 11. Межмолекулярная водородная связь между молекулами аммиака
- 12. Сформулируйте определение водородной связи Водородная связь-связь между катионами водорода одной молекулы с электроотрицательным элементом другой молекулы.
- 13. Отражается ли водородная связь на физических свойствах спиртов? Межмолекулярная водородная связь между молекулами спиртов (метанол, этанол,
- 14. 1.Особенность физических свойств: агрегатное состояние. Метиловый спирт -первый представитель гомологического ряда спиртов– жидкость. Может быть у
- 15. 2.Особенность физических свойств: растворимость в воде. Низшие спирты растворимы в воде, высшие – не растворимы. Почему?
- 16. Поднимите плечи вверх, отведите назад и опустите; Закройте глаза и вращая головой, напишите формулу этилового спирта.
- 17. Химические свойства предельных одноатомных спиртов Спирты – это кислоты? Спирты реагируют со щелочными металлами. При этом
- 18. Реакция с галогеноводородами. Эта реакция обратима и требует катализатора- концентрированной серной кислоты. СН3 – СН2 –
- 19. Реакция этерификации При действии на спирты минеральных и органических кислот образуются сложные эфиры. Образование сложных эфиров
- 20. Окисление спиртов Спирты окисляются под действием оксида меди(II), дихромата или перманганата калия до карбонильных соединений. Первичные
- 21. Дегидратация внутримолекулярная Отнятие воды –дегидратация при температуре больше 140 градусов и катализаторе (серная кислота). СН2 –
- 22. Межмолекулярная дегидратация Если температуру уменьшить, а катализатор оставить тот же, то произойдет межмолекулярная дегидратация. СН3 –
- 23. Вывод о строении и свойствах спиртов Между молекулами спиртов есть водородная связь и это определяет их
- 24. МАЛЕНЬКИЙ РЕБЁНОК МОЖЕТ ПОГИБНУТЬ от стакана ВОДКИ Смертельная доза для взрослого 6-8 г спирта на 1
- 25. Статистика смертности Смертность среди мужчин увеличилась в 2,5 раза, среди женщин – в 3 раза. В
- 26. Метаболит спирта Повреждение печени Цирроз печени Мутации и уродства эмбрионов
- 27. Пивной алкоголизм Кто пиво пьет больше, у того брюхо толще. «Ожирение сердца»
- 28. Изменения в головном мозге 100г вина убивает 500 нейронов 100г пива убивает 3000 нейронов 100г водки
- 29. Домашнее задание 1)Параграф 9 2)Выучить уравнения 3)Решить задачи по уровням сложности
- 31. Скачать презентацию




























 Свойства топлив. Марки бензинов и их характеристики
Свойства топлив. Марки бензинов и их характеристики Определение окисляемости воды
Определение окисляемости воды Основные задачи и понятия химической метрологии
Основные задачи и понятия химической метрологии Удивительные свойства воды
Удивительные свойства воды Классификация химических элементов
Классификация химических элементов Классификация и свойства кислот
Классификация и свойства кислот Контроль качества пищевых товаров
Контроль качества пищевых товаров Кислород и оксиген
Кислород и оксиген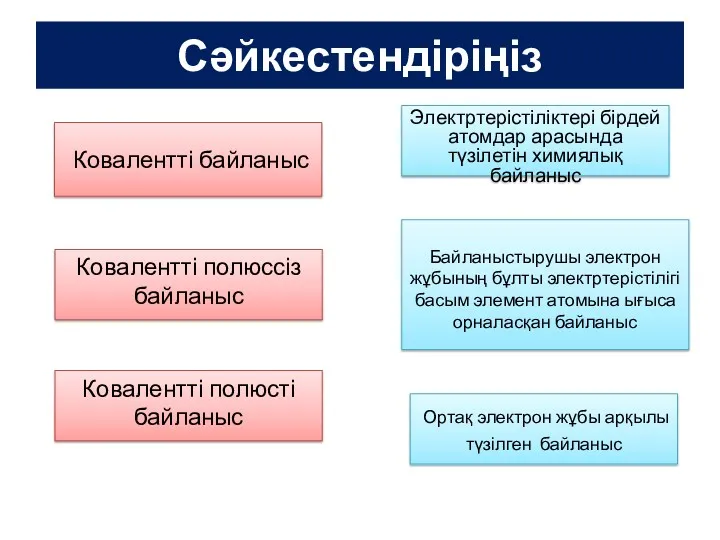 Иондық байланыс
Иондық байланыс Газовые смеси
Газовые смеси Алюминий и его соединения
Алюминий и его соединения Кислород. Химия – 8 класс
Кислород. Химия – 8 класс Углекислый газ СО2
Углекислый газ СО2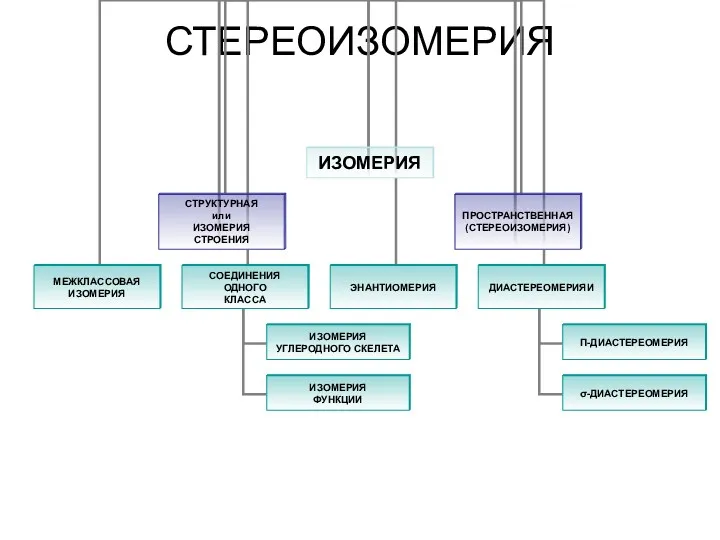 Стереоизомерия. Изомерия. Пространственная (стереоизомерия) углеродного скелета
Стереоизомерия. Изомерия. Пространственная (стереоизомерия) углеродного скелета 20230212_urok_ionnye_uravneniya
20230212_urok_ionnye_uravneniya Ароматические углеводороды (Арены)
Ароматические углеводороды (Арены) Спирти. 3агальна характеристика спиртів
Спирти. 3агальна характеристика спиртів Тотығу-тотықсыздану реакциялары
Тотығу-тотықсыздану реакциялары Растворы. Свойства растворов. (Тема 3)
Растворы. Свойства растворов. (Тема 3) Кондуктометрия и кондуктометрическое титрование
Кондуктометрия и кондуктометрическое титрование Гидролиз неорганических веществ (теоретический материал для подготовки к ЕГЭ)
Гидролиз неорганических веществ (теоретический материал для подготовки к ЕГЭ) Качественный анализ (часть 1)
Качественный анализ (часть 1) Нанопористые материалы
Нанопористые материалы Понятие о спиртах. 9 класс
Понятие о спиртах. 9 класс Щелочные металлы. Положение в ПСХЭ
Щелочные металлы. Положение в ПСХЭ Тайна великого открытия периодической таблицы
Тайна великого открытия периодической таблицы Разработка проектных решений по переводу паровых котлов электростанций в конденсационный режим с целью увеличения кпд котла
Разработка проектных решений по переводу паровых котлов электростанций в конденсационный режим с целью увеличения кпд котла Понятие биогенности химических элементов
Понятие биогенности химических элементов