Содержание
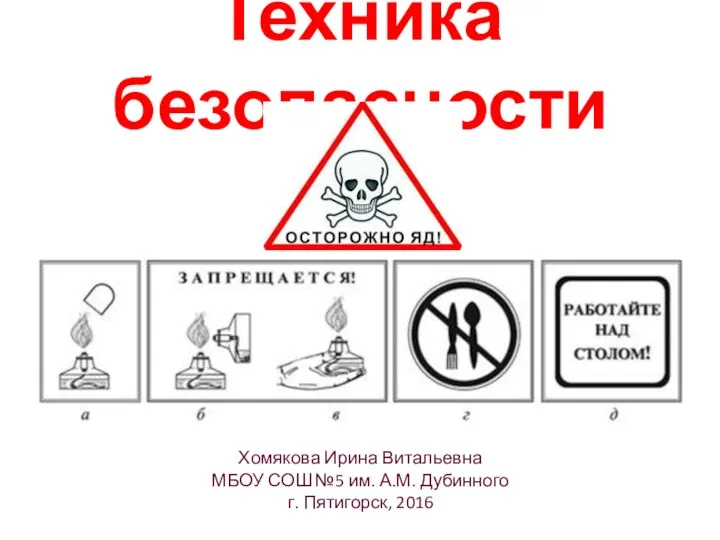
- 2. Техника безопасности Хомякова Ирина Витальевна МБОУ СОШ №5 им. А.М. Дубинного г. Пятигорск, 2016
- 3. Хомякова Ирина Витальевна МБОУ СОШ №5 им. А.М. Дубинного г. Пятигорск, 2016
- 4. Что такое качественный анализ? Качественный анализ – это идентификация (обнаружение) компонентов анализируемых веществ и материалов и
- 5. Аналитическая реакция - это реакция, которая сопровождается каким-либо внешним эффектом (образование или растворение осадка, выделение газа,
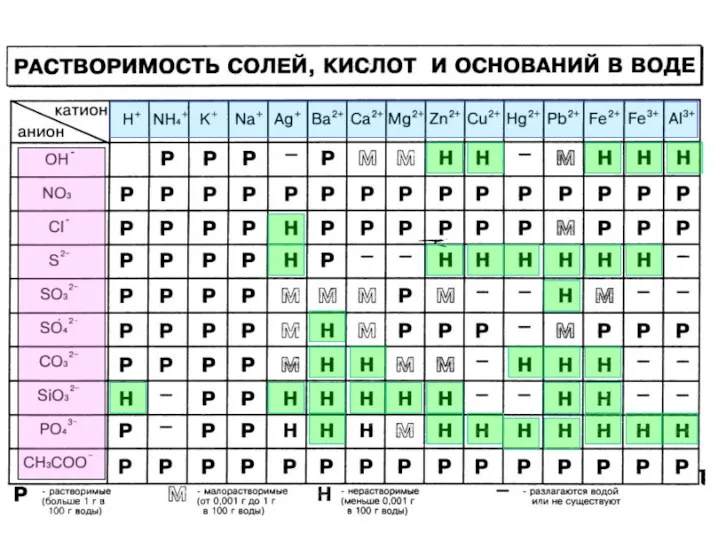
- 6. Реакции ионного обмена BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl Хомякова Ирина Витальевна МБОУ СОШ №5
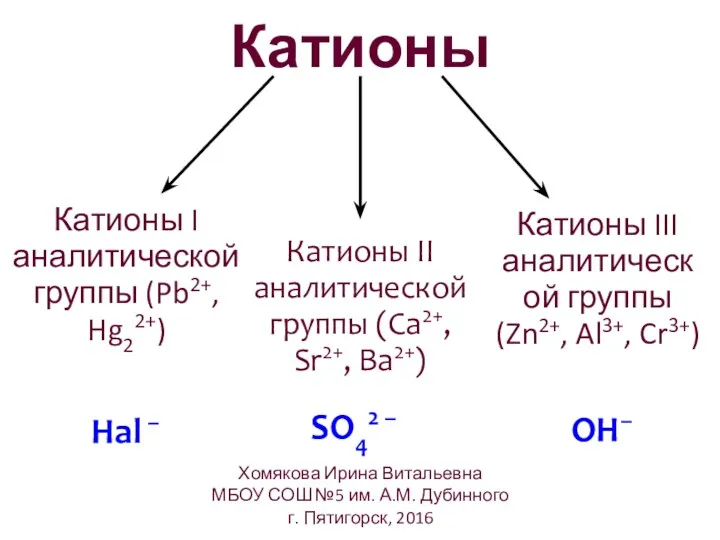
- 8. Катионы Катионы I аналитической группы (Pb2+, Hg22+) Катионы II аналитической группы (Ca2+, Sr2+, Ba2+) SO42 –
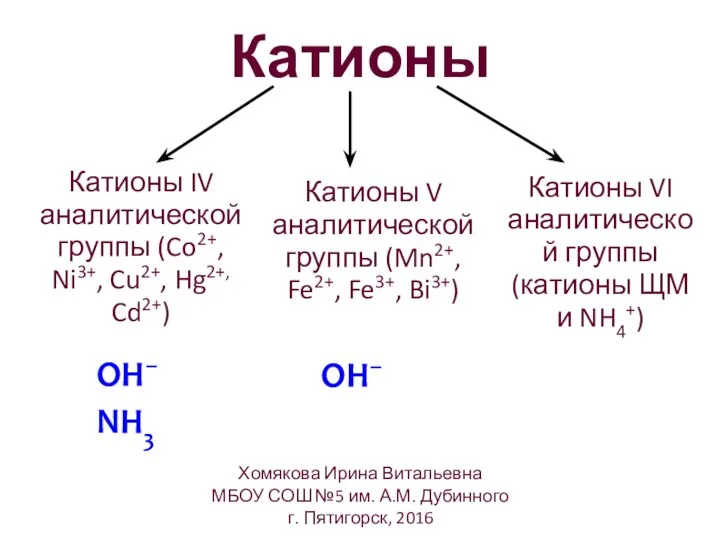
- 9. Катионы OH– OH– NH3 Катионы V аналитической группы (Mn2+, Fe2+, Fe3+, Bi3+) Катионы VI аналитической группы
- 10. Качественная реакция на Pb2+ Pb2+ + 2Cl- = PbCl2↓ Hg22+ + 2Cl- = Hg2Cl2↓ Pb2+ +
- 11. Качественная реакция на Ba2+ Pb2+ + 2Cl- = PbCl2↓ Hg22+ + 2Cl- = Hg2Cl2↓ Pb2+ +
- 12. Как распознать Cu2+? Cu2+ + 2NH3·H2O + SO42- = Cu2(OH)2SO4↓+ 2NH4+ Cu2(OH)2SO4 + 4NH3·H2O = [Cu(NH3)4]2+
- 13. Как распознать Ni2+? Ni2+ + 2NH3·H2O = Ni(OH)2↓ + 2NH4+ Ni(OH)2 + 6NH3·H2O = [Ni(NH3)6]2+ +
- 14. Соединения никеля Хомякова Ирина Витальевна МБОУ СОШ №5 им. А.М. Дубинного г. Пятигорск, 2016
- 15. Как распознать Fe3+? Способ 1 К анализируемому раствору добавить р-р NaOH или KOH Если выпал бурый
- 16. Как распознать Fe3+? Способ 2 К анализируемому раствору добавить р-р KSCN Если раствор стал ярко красным,
- 17. Как распознать NH4+? К анализируемому раствору добавить избыток водного раствора NaOH или KOH Нагреть полученный раствор
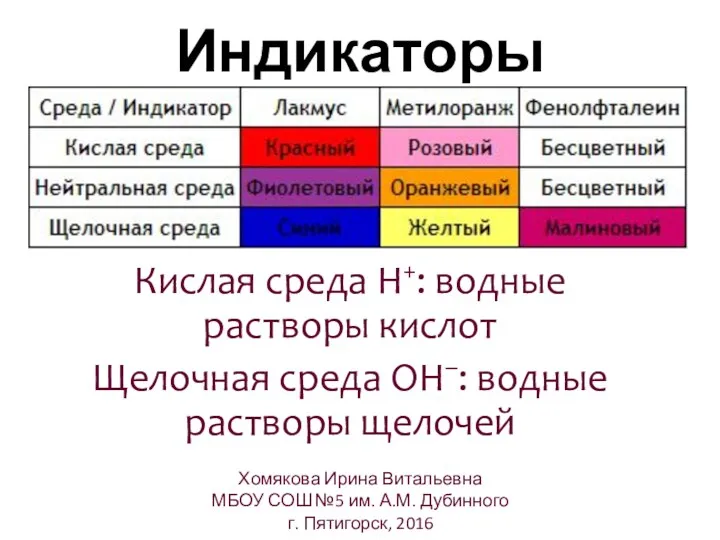
- 18. Индикаторы Кислая среда H+: водные растворы кислот Щелочная среда ОH–: водные растворы щелочей Хомякова Ирина Витальевна
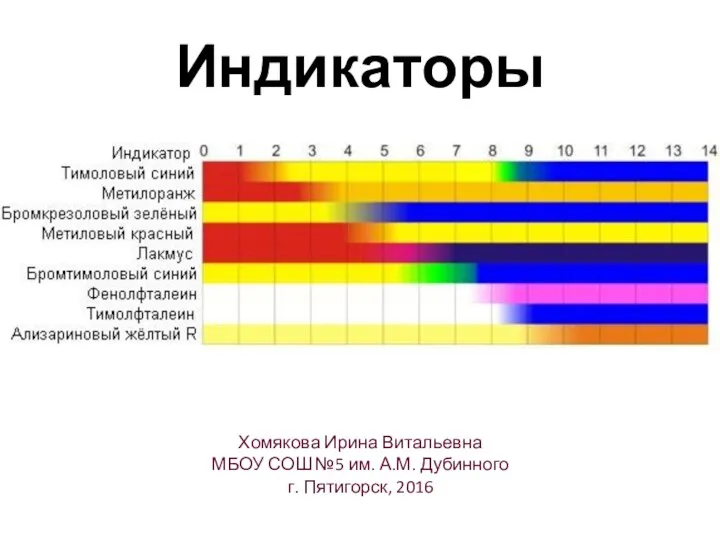
- 19. Индикаторы Хомякова Ирина Витальевна МБОУ СОШ №5 им. А.М. Дубинного г. Пятигорск, 2016
- 20. Метилоранж pH > 7 pH Фенолфталеин pH > 7
- 22. Скачать презентацию













 Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы
Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы Кислоты, их состав и названия
Кислоты, их состав и названия Карбоновые кислоты и их функциональные производные
Карбоновые кислоты и их функциональные производные Ароматические углеводороды
Ароматические углеводороды Гетерофазный катализ. (Лекция 20)
Гетерофазный катализ. (Лекция 20) Горение топлива
Горение топлива Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології
Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології Основные классы неорганических соединений
Основные классы неорганических соединений Соли, их классификация и свойства
Соли, их классификация и свойства Органічна хімія
Органічна хімія Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14
Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14 Жёсткость воды
Жёсткость воды Полисахариды: крахмал и целлюлоза
Полисахариды: крахмал и целлюлоза Растворы. Часть 2. Лекция №7
Растворы. Часть 2. Лекция №7 Химия атмосферы. Химические процессы в тропосфере
Химия атмосферы. Химические процессы в тропосфере Буферные системы
Буферные системы Белки. Строение
Белки. Строение Классификация химических элементов. Составитель. 8 класс
Классификация химических элементов. Составитель. 8 класс Минералы для ИЗБ
Минералы для ИЗБ Концентрация растворов. Массовая доля растворенного вещества. Урок 1
Концентрация растворов. Массовая доля растворенного вещества. Урок 1 Химический элемент медь
Химический элемент медь Кинетика химических реакций
Кинетика химических реакций Кремний и его соединения
Кремний и его соединения Галогены. Расположите галогены в порядке их открытия
Галогены. Расположите галогены в порядке их открытия Важнейшие реакции в органической химии
Важнейшие реакции в органической химии Технология производства аминоальдегидных смол
Технология производства аминоальдегидных смол Углерод. Физические и химические свойства
Углерод. Физические и химические свойства Гидролиз солей
Гидролиз солей