Содержание
- 2. Запомните! Каждому кислотному оксиду соответствует определенная кислота. Например: СО2 → Н2СО3 SО2 → H2SО3 SО3 →
- 3. Запомните! Каждому основному оксиду соответствует определенное основание. Например: Na2O → NaOH CaO → Ca(OH)2 Al2O3 →
- 4. СаО + Н2O → Ca(OH)2 (Осн. оксид + вода = основание) СаО + H2SO4 → CaSO4
- 5. Самостоятельная работа Напишите уравнения реакций химических свойств следующих оксидов:
- 6. Домашнее задание: Выучить схему. Составить уравнения реакций химических свойств следующих оксидов: N2O5 и Al2O3.
- 7. Содержание Тема урока №1: «Кислоты, их состав и названия» Состав кислот Что такое кислоты Классификация кислот
- 8. Состав кислот HCl H2SO4 H3PO4 1. Кислоты – это простые или сложные вещества? 2. Что общего
- 9. H Cl = H+ + Cl – H2 SO 4 = 2 H+ + SO42- Кислоты
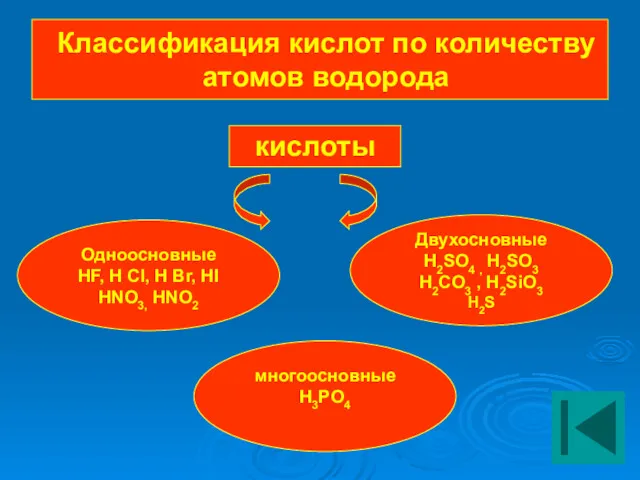
- 10. Классификация кислот по количеству атомов водорода Одноосновные HF, H Cl, H Br, HI HNO3, HNO2 кислоты
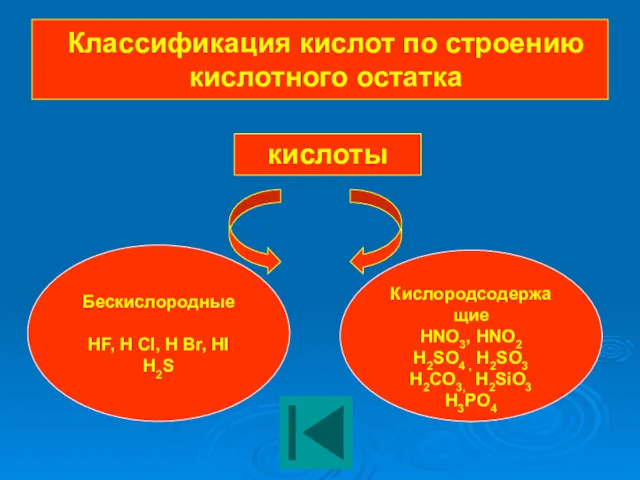
- 11. Классификация кислот по строению кислотного остатка кислоты Бескислородные HF, H Cl, H Br, HI H2S Кислородсодержащие
- 12. Нахождение кислот в природе Лимонная кислота содержится в лимонах, яблочная кислота - в яблоках, щавелевая кислота
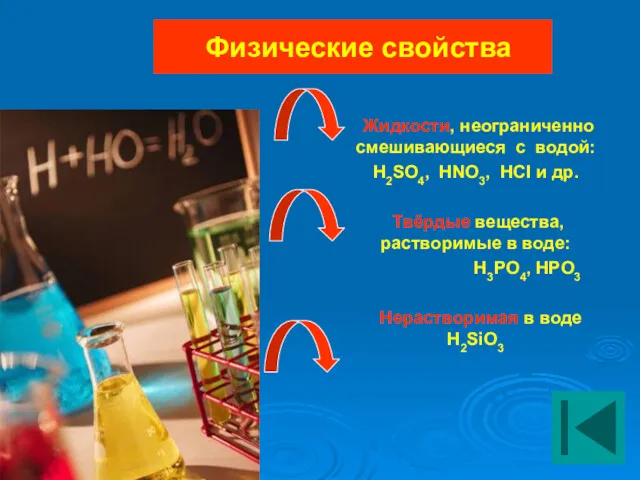
- 13. Физические свойства Жидкости, неограниченно смешивающиеся с водой: H2SO4, HNO3, HCI и др. Твёрдые вещества, растворимые в
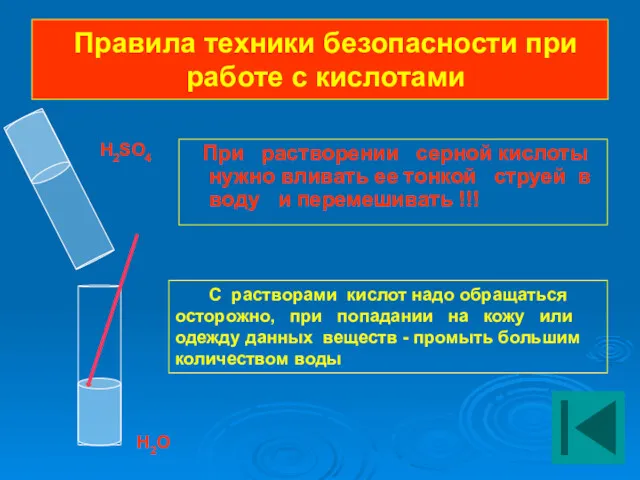
- 14. Правила техники безопасности при работе с кислотами При растворении серной кислоты нужно вливать ее тонкой струей
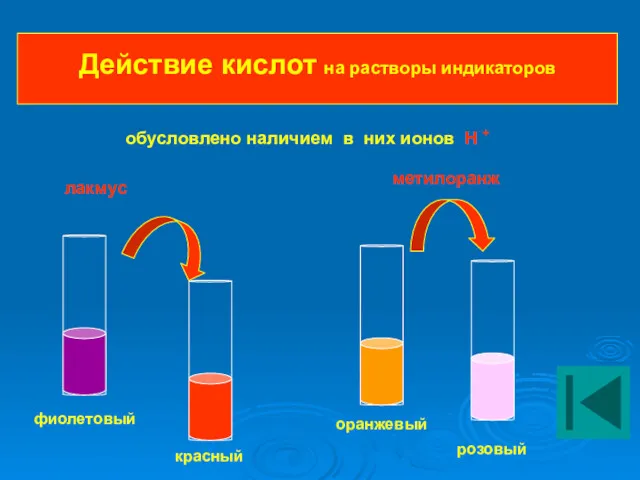
- 15. Действие кислот на растворы индикаторов фиолетовый красный оранжевый розовый лакмус метилоранж обусловлено наличием в них ионов
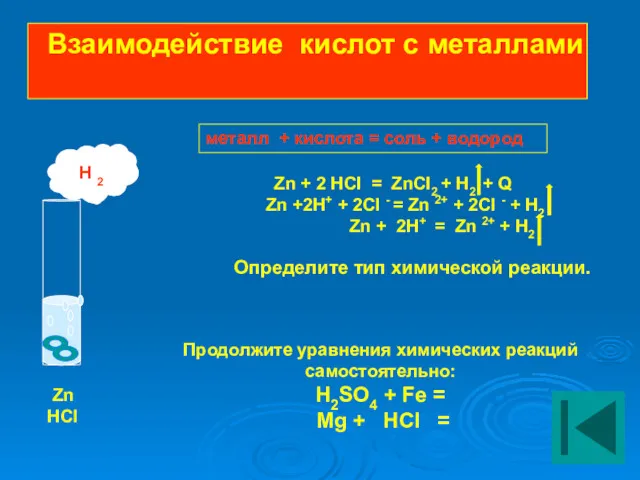
- 16. Взаимодействие кислот с металлами Zn + 2 HCI = ZnCI2 + H2 + Q Zn +2H+
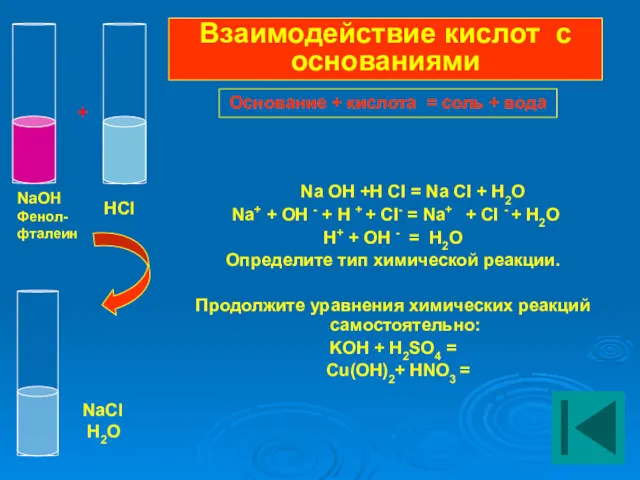
- 17. Na OH +H CI = Na CI + H2O Na+ + OH - + H +
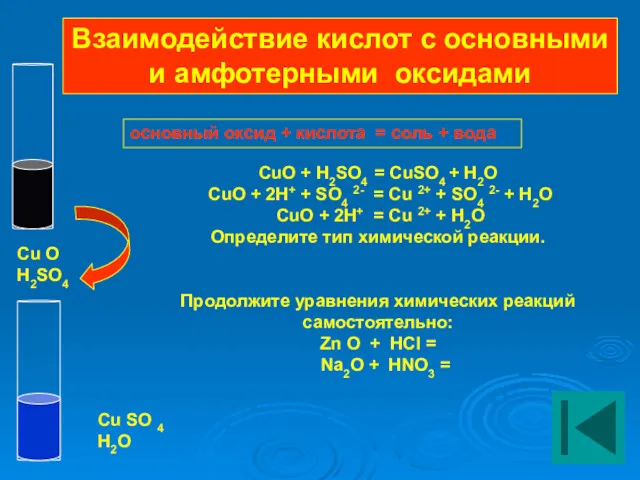
- 18. основный оксид + кислота = соль + вода CuO + H2SO4 = CuSO4 + H2O CuO
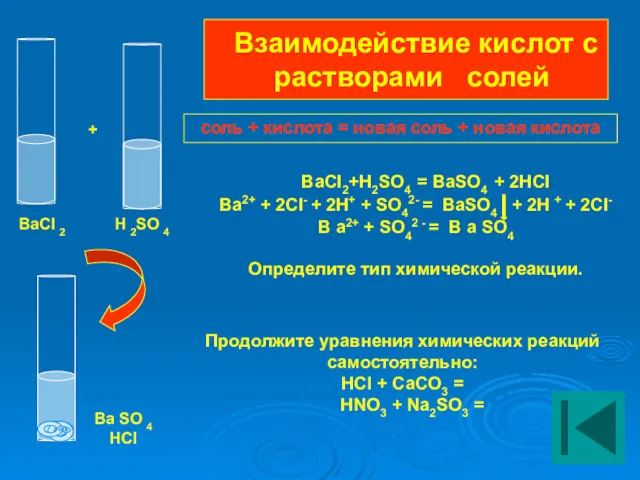
- 19. Взаимодействие кислот с растворами солей BaCI2+H2SO4 = BaSO4 + 2HCI Ba2+ + 2CI- + 2Н+ +
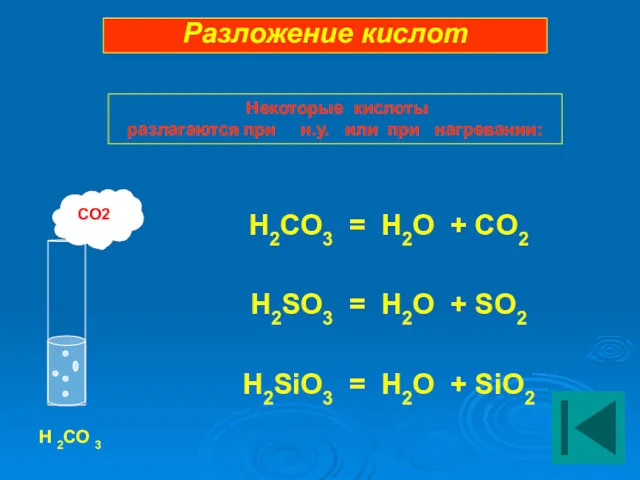
- 20. H2CO3 = H2O + CO2 H2SO3 = H2O + SO2 H2SiO3 = H2O + SiO2 CO2
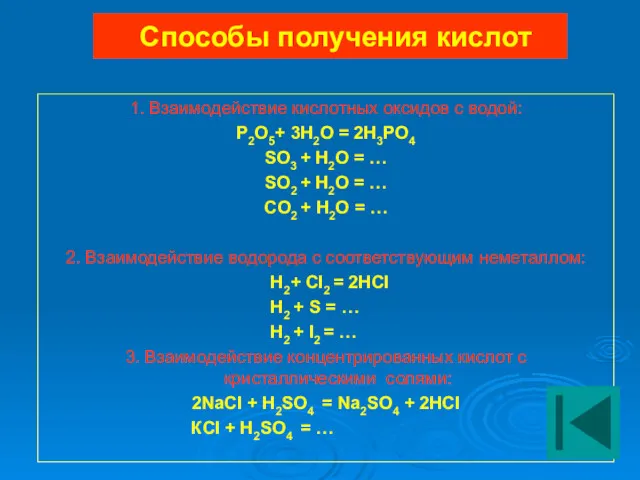
- 21. Способы получения кислот 1. Взаимодействие кислотных оксидов с водой: P2O5+ 3H2O = 2H3PO4 SO3 + H2O
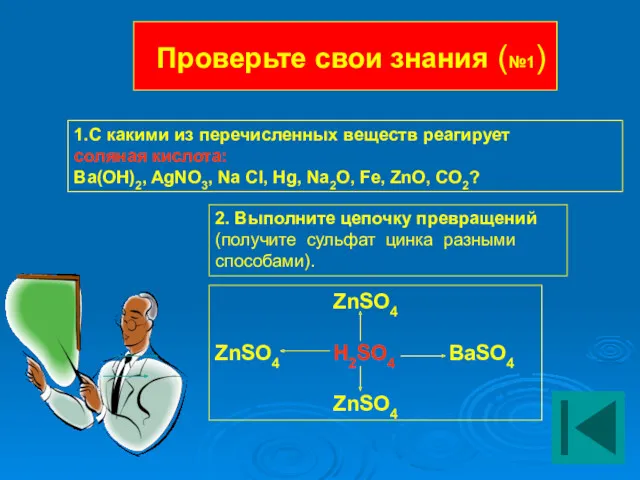
- 22. Проверьте свои знания (№1) 1.С какими из перечисленных веществ реагирует соляная кислота: Ba(OH)2, AgNO3, Na Cl,
- 23. Пора отправится в гости .Однако, чтобы попасть в дом, необходимо вспомнить адрес хозяев, их имена и
- 24. Мы попали в комнату, где много гостей. Необходимо найти хозяев и выделить их ( выписать формулы
- 25. Чтобы вы не скучали, кислоты придумали игру «Угадай». Назовите номера практически возможных реакций. 1) AL+ HCL=
- 26. Один рассеянный человек писал уравнения реакций и потерял свои записи, остались в памяти только продукты реакции.
- 27. 3. Закончите молекулярные уравнения возможных реакций и запишите соответствующие им ионные уравнения: Al2О3 + H Cl
- 29. Скачать презентацию














 Удивительные свойства воды
Удивительные свойства воды Electronică aplicată. (Curs 2)
Electronică aplicată. (Curs 2) Пространственное строение органических соединений. (Лекция 2)
Пространственное строение органических соединений. (Лекция 2) 20230416_urok_na_20.02.2023
20230416_urok_na_20.02.2023 Неізогіпсичні перетворення функціональних груп. Реакції окиснення
Неізогіпсичні перетворення функціональних груп. Реакції окиснення Виды присадок к моторным топливам. Присадки к дизельному топливу
Виды присадок к моторным топливам. Присадки к дизельному топливу Электронная конфигурация К. Классификация химических элементов. 8 класс
Электронная конфигурация К. Классификация химических элементов. 8 класс Спирты. Физические и химические свойства
Спирты. Физические и химические свойства Сучасні методи органічного синтезу. Ізогіпсичні перетворення функціональних груп. Реакції приєднання. Гідроборування
Сучасні методи органічного синтезу. Ізогіпсичні перетворення функціональних груп. Реакції приєднання. Гідроборування 20230321_obobshchenie_po_elektroliticheskoy_dissotsiatsii
20230321_obobshchenie_po_elektroliticheskoy_dissotsiatsii Классификация органических соединений, углеводородов
Классификация органических соединений, углеводородов Типовые процессы технологии неорганических веществ. (Тема 3)
Типовые процессы технологии неорганических веществ. (Тема 3) ЕГЭ Химия. Задание №5
ЕГЭ Химия. Задание №5 Изучение строения и свойств глюкозы
Изучение строения и свойств глюкозы Железо и его соединения
Железо и его соединения Химические превращения веществ
Химические превращения веществ Белки. Функции белков
Белки. Функции белков Високомолекулярні сполуки. Полімери
Високомолекулярні сполуки. Полімери Простые спектры 1Н ЯМР
Простые спектры 1Н ЯМР Значення хімічних процесів у природі
Значення хімічних процесів у природі Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1. 9 клас
Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1. 9 клас Реакции ионного обмена
Реакции ионного обмена Жиры. Мыла. 10 класс
Жиры. Мыла. 10 класс Группа редкоземельных элементов
Группа редкоземельных элементов Аммиак. № 12 зертханалық тәжірибе Аммиак молекуласының моделі
Аммиак. № 12 зертханалық тәжірибе Аммиак молекуласының моделі Железо
Железо Crystallography. Part 4: Crystal Forms Twinning
Crystallography. Part 4: Crystal Forms Twinning Функциональные производные с простой связью C-“Э. Галогенпроизводные. (Лекция 5)
Функциональные производные с простой связью C-“Э. Галогенпроизводные. (Лекция 5)