Содержание
- 2. «Чёрная коробочка» В ее честь названы многие города, реки и озера. Она необходима организму человека каждый
- 3. Соли Соленые Растворимые Минеральные Ядовитые Кислые Признак Особая черта Отличительная черта Особенность Качество СВОЙСТВА
- 4. Химические свойства солей Тема урока *
- 5. ЗНАТЬ: химические свойства солей.
- 6. УМЕТЬ: характеризовать общие химические свойства солей; записывать уравнения реакций, отражающие свойства солей; пользоваться рядом активности металлов.
- 7. Химические свойства солей Соли взаимодействуют: с щелочами; с кислотами; с солями; с металлами.
- 8. 1. Взаимодействие солей с щелочами Демонстрация опыта CuSO4 + NaOH = KCl + NaOH = ВЫВОД:
- 9. 2. Взаимодействие солей с кислотами Практическая работа Na2CO3 + HCl = AgNO3 + HCl = Na2SO4
- 10. Демонстрация опыта BaCl2 + Na2SO4 = BaCl2 + AgNO3 = BaCl2 + NaNO3 = 3. Взаимодействие
- 11. Электрохимический ряд напряжений металлов Li K Ba Ca Na Mg Al Mn Zn Cr Fe Co
- 12. Медный купорос, или пятиводный раствор сульфата меди - неорганическое соединение CuSO4 ∙ 5H2O
- 13. 4. Взаимодействие солей с металлами Практическая работа CuSO4 + Fe = Na2SO4 + Fe = ВЫВОД:
- 14. Взаимодействие металлов с соляим
- 15. На уроке мы узнали, что … : Соли взаимодействуют с кислотами и щелочами, если … Раствор
- 16. Домашнее задание §26 №6 письменно Творческое задание Найдите города, реки и озера, в названиях которых есть
- 17. Факты о поваренной соль NaCl Весной 1648 года в Москве произошёл Соляной бунт, вызванный непомерно высоким
- 19. Скачать презентацию
















 Побочная подгруппа VIII группы периодической системы
Побочная подгруппа VIII группы периодической системы Ароматические кислоты и их производные. Общая характеристика, методы получения и исследования
Ароматические кислоты и их производные. Общая характеристика, методы получения и исследования Хімічні властивості металів
Хімічні властивості металів Techniques for preparation of gaseous samples with a desired concentration of analyte
Techniques for preparation of gaseous samples with a desired concentration of analyte НОМЕНКЛАТУРА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
НОМЕНКЛАТУРА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ Гидроксид магния. Mg(OH)2
Гидроксид магния. Mg(OH)2 Общие сведения о полезных ископаемых. (Лекция 2)
Общие сведения о полезных ископаемых. (Лекция 2) Вуглеводи
Вуглеводи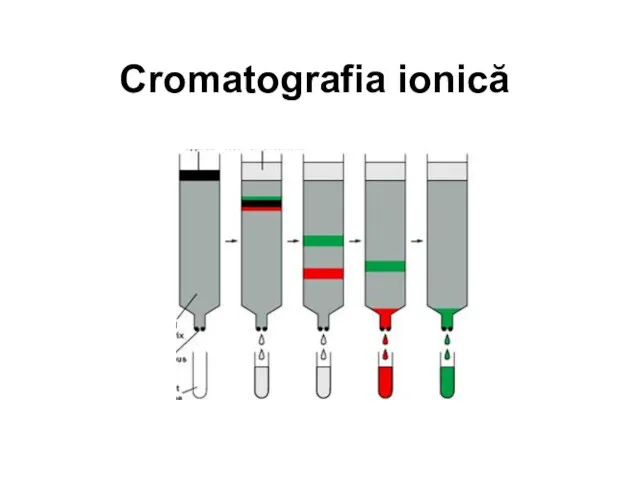 Cromatografia ionică
Cromatografia ionică Аналитические методы
Аналитические методы Каталитический риформинг
Каталитический риформинг циклоалканы170
циклоалканы170 Современные тенденции развития химии
Современные тенденции развития химии Термодинамика
Термодинамика Комплексные соединения
Комплексные соединения Алкины. Ацетилен (Этин) – С2Н2
Алкины. Ацетилен (Этин) – С2Н2 Катализ и катализаторы
Катализ и катализаторы Тепловой эффект химической реакции. 11 класс
Тепловой эффект химической реакции. 11 класс Непредельные углеводороды ряда этилена
Непредельные углеводороды ряда этилена Предмет аналитической химии, ее структура
Предмет аналитической химии, ее структура Ионы. Проверочная работа
Ионы. Проверочная работа Применение здм к кислотно-основным равновесиям и их роль в аналитической химии
Применение здм к кислотно-основным равновесиям и их роль в аналитической химии Химическая связь
Химическая связь Аммиак
Аммиак Неметаллы. Общая характеристика
Неметаллы. Общая характеристика Алкины. 10 класс
Алкины. 10 класс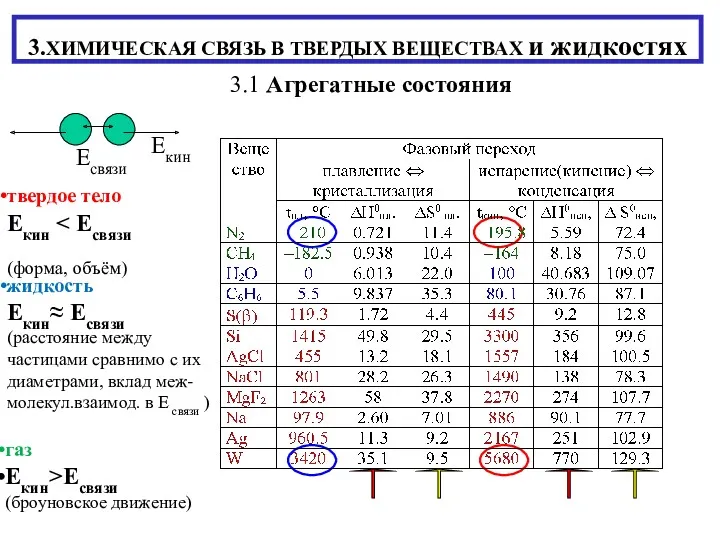 Химическая связь в твердых веществах и жидкостях
Химическая связь в твердых веществах и жидкостях ae2db93272ef42dba476a56bbc56b895
ae2db93272ef42dba476a56bbc56b895