Содержание
- 2. не рассматривает внутреннее строение тел и механизм протекающих в них процессов; изучает только макроскопические системы (порядка
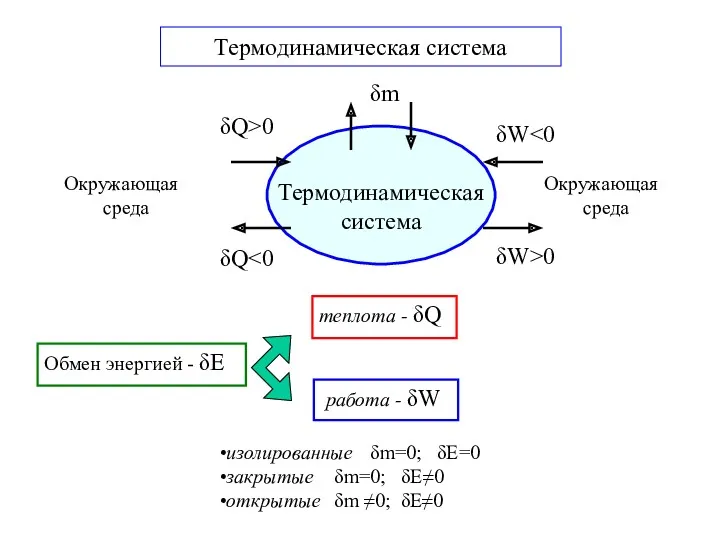
- 3. теплота - δQ работа - δW изолированные δm=0; δE=0 закрытые δm=0; δE≠0 открытые δm ≠0; δE≠0
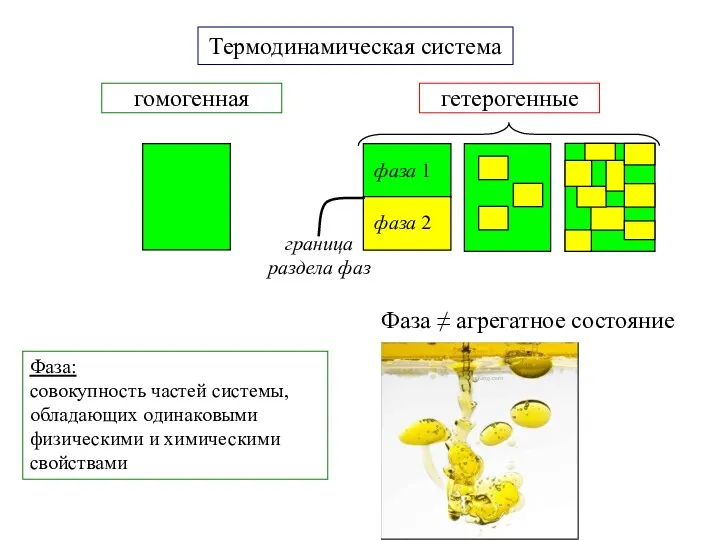
- 4. Фаза: совокупность частей системы, обладающих одинаковыми физическими и химическими свойствами Термодинамическая система Фаза ≠ агрегатное состояние
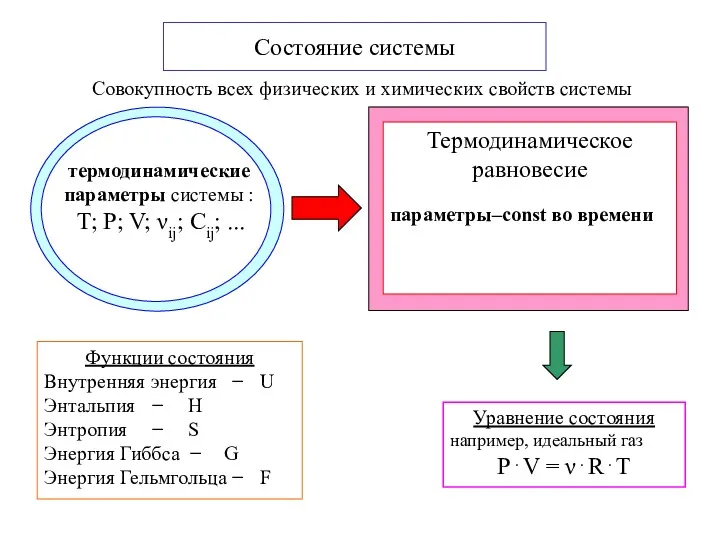
- 5. Функции состояния Внутренняя энергия − U Энтальпия − H Энтропия − S Энергия Гиббса − G
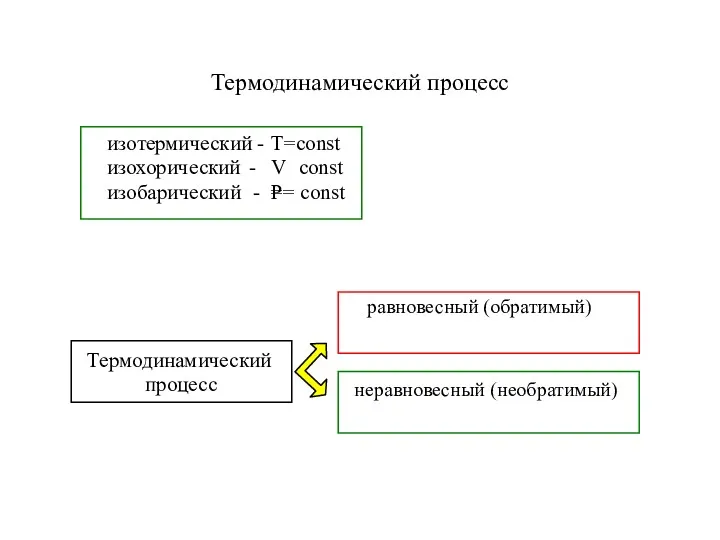
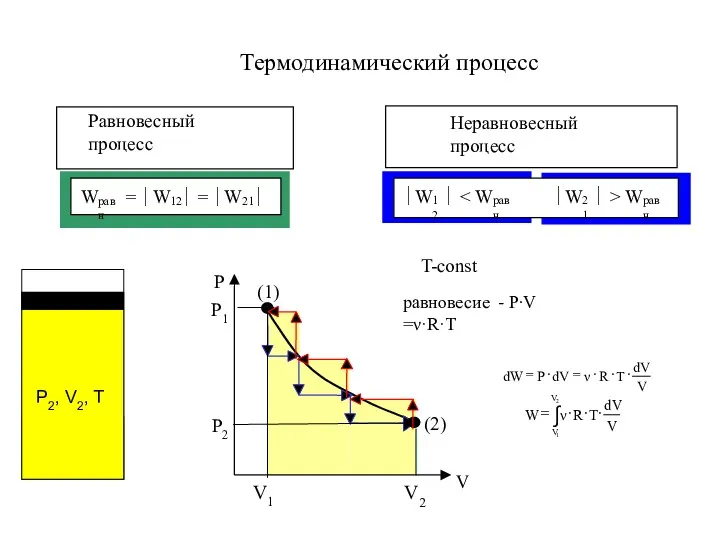
- 6. Термодинамический процесс
- 7. Термодинамический процесс
- 8. T-const Термодинамический процесс равновесие - P∙V =ν·R·T
- 9. Химическая реакция αА + βB = γC + δD α,β,γ,δ – стехиометрические коэффициенты
- 10. Теплота (Δ Q), сообщенная термодинамической системе, идет на увеличение внутренней энергии (Δ U) системы и на
- 11. если Т2 > Т1, то UТ2 >UТ1 термодинамическая шкала температур Т, К Внутренняя энергия U
- 12. Энтальпия
- 13. Тепловой эффект химической реакции
- 15. Теплота сгорания вещества – тепловой эффект реакции окисления 1 моля вещества в избытке кислорода до высших
- 16. Теплота растворения – тепловой эффект процесса растворения 1 моля вещества в бесконечно большом количестве растворителя. ∆Нраств
- 17. Теплота образования вещества – тепловой эффект реакции образования 1 моля сложного вещества из простых. Теплоты образования
- 18. Стандартные условия: Р0 = 1,013⋅105 Па Т0 = 298,15 К С0 = 1моль/л ΔfН0298 стандартная энтальпия(теплота)
- 19. Закон Г.И.Гесса «тепловой эффект реакции зависит только от вида и состояния исходных веществ и конечных продуктов
- 20. Следствие из закона Гесса: ΔrН0298 = (∑ νiΔfН0i)продукты – (∑ νiΔfН0i)исходные вещества Пример. реакция : CH4
- 21. Зависимость энтальпии образования в-ва от температуры
- 22. пример - Н2О
- 23. Для обратимых (равновесных) процессов Второе начало термодинамики. Энтропия Термодинамическая энтропия - термодинамическая функция, характеризующая меру необратимого
- 24. Второе начало термодинамики. в изолированной системе самопроизвольно протекают процессы с увеличением энтропии (dS > 0) при
- 25. Обратимые процессы: термодинамическая энтропия изолированной системы остается постоянной. (ΔS = 0) Необратимые процессы: возрастание энтропии всей
- 26. S = k⋅lnW k = 1,38⋅10-23Дж/К – константа Больцмана (k = R/NА) W – термодинамическая вероятность
- 27. Энтропия W1= 1 W2= 4 W3= 6 W4= 4 W5= 1 I – V варианты распределения
- 28. S [Дж/К] S0298 [Дж/моль⋅К] Факторы влияющие на величину энтропии
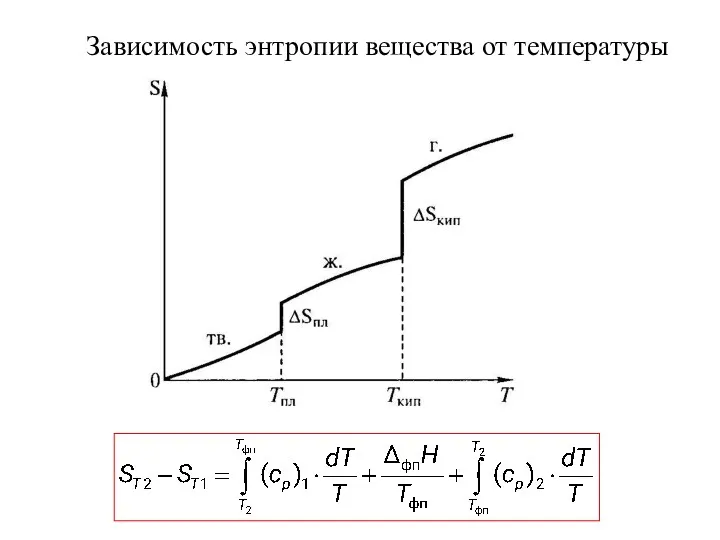
- 29. Зависимость энтропии вещества от температуры
- 30. Критерии самопроизвольности протекания химических процессов Для изолированной системы: реакция протекает в сторону увеличения энтропии. увеличение числа
- 31. Свободная энергия ΔF = ΔU – T⋅ΔS ΔG = ΔH – T⋅ΔS ΔU = ΔF +T⋅ΔS
- 32. Свободная энергия Гиббса Свободная энергия Гиббса - это величина, показывающая изменение энергии в ходе химической реакции
- 33. Температурная зависимость ΔrG Направление протекания химической реакции
- 35. Скачать презентацию





















![S [Дж/К] S0298 [Дж/моль⋅К] Факторы влияющие на величину энтропии](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/172366/slide-27.jpg)




 Ртуть и цинк
Ртуть и цинк Драгоценные камни
Драгоценные камни Соли, их классификация и свойства
Соли, их классификация и свойства Степень окисления. Определение степени окисления в соединениях
Степень окисления. Определение степени окисления в соединениях Теория электролитической диссоциации
Теория электролитической диссоциации Химия и биологическая роль элементов VIIА-группы
Химия и биологическая роль элементов VIIА-группы Студенттің өзіндік жұмысы
Студенттің өзіндік жұмысы Составление уравнений химических реакций. Закон сохранения массы веществ
Составление уравнений химических реакций. Закон сохранения массы веществ Водород
Водород Соединения кальция. Жесткость воды и способы её устранения
Соединения кальция. Жесткость воды и способы её устранения Алкени (етиленові вуглеводні, олефіни)
Алкени (етиленові вуглеводні, олефіни) Коррозия металлов
Коррозия металлов Строение, свойства и применение алкенов
Строение, свойства и применение алкенов Дистилляция в химической промышленности
Дистилляция в химической промышленности Хлорид натрия (NaCI)
Хлорид натрия (NaCI) Кислород. Озон. Получение кислорода
Кислород. Озон. Получение кислорода Өндірілетін және тиелетін өнімнің сапасын бақылау, оларға қойылатын талаптар
Өндірілетін және тиелетін өнімнің сапасын бақылау, оларға қойылатын талаптар 20230802_stroenie_atoma_avtosohranennyy_2
20230802_stroenie_atoma_avtosohranennyy_2 Хімічні властивості алкенів
Хімічні властивості алкенів Биоразлагаемые ПАВ. Лекция 2
Биоразлагаемые ПАВ. Лекция 2 Принципы наноармирования волокнистых композитов
Принципы наноармирования волокнистых композитов Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Альдегиды и кетоны
Альдегиды и кетоны Искусственная и синтетическая резина
Искусственная и синтетическая резина Мұнай құрамындағы тұздың мөлшерін анықтау
Мұнай құрамындағы тұздың мөлшерін анықтау Неомыляемые липиды. Изопреноиды
Неомыляемые липиды. Изопреноиды Задачи на избыток-недостаток
Задачи на избыток-недостаток Синтетический каучук и его применение
Синтетический каучук и его применение