Слайд 2

Что такое соли?
Соли – это класс химических соединений, состоящих из
ионов металла и ионов кислотного остатка.
(Например: NaCl, NH4NO3, AgY)
Солями называют электролиты, которые при диссоциации образуют катионы металла (или аммония NH4+) и анионы кислотных остатков.
(Например: K3PO4 = 3K+ + PO43- )
Слайд 3

Классификация солей
По растворимости в воде
Растворимые Нерастворимые
Малорастворимые
Аммиачная селитра
NH4NO3 Сульфат кальция
Фосфат
Слайд 4

Классификация солей
2) По наличию или отсутствию кислорода
Кислородсодержащие Бескислородные
Например: Например:
Na2SO4 (сульфат натрия) NaBr (бромид натрия)
KNO3 (нитрат калия) KY (иодид калия)
Ca(NO2)2 (нитрит кальция) CaCl2 (хлорид кальция)
Слайд 5

Разновидности солей
Соли бывают:
Средние соли – это продукты полного замещения атомов водорода
в кислоте на металл.
Например: Na2CO3 (карбонат натрия)
CuSO4 (сульфат меди)
Диссоциация средних солей:
Na2CO3 = 2Na+ + CO32-
Слайд 6

Разновидности солей
2) Кислые соли – это продукты неполного замещения атомов
водорода в кислоте на металл.
Например:
NaHCO3 (гидрокарбонат натрия)
Mg(HSO4)2 (гидросульфат магния)
Диссоциация кислых солей:
Ca(HSO4)2 = Ca2+ + 2HSO4-
Слайд 7

Разновидности солей
3) Основные соли – это продукты неполного замещения гидроксогрупп
в основании на кислотный остаток.
Например:
(CuOH)2CO3 (гидроксокарбонат меди (II))
AlOHCl2 (гидроксохлорид алюминия)
Диссоциация основных солей:
AlOHCl2 = AlOH2+ + 2Cl-
Слайд 8
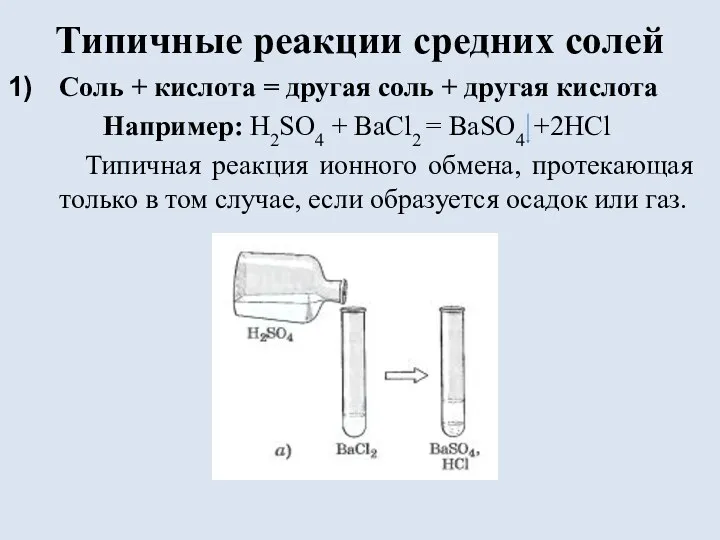
Типичные реакции средних солей
Соль + кислота = другая соль + другая
кислота
Например: H2SO4 + BaCl2 = BaSO4 +2HCl
Типичная реакция ионного обмена, протекающая только в том случае, если образуется осадок или газ.
Слайд 9
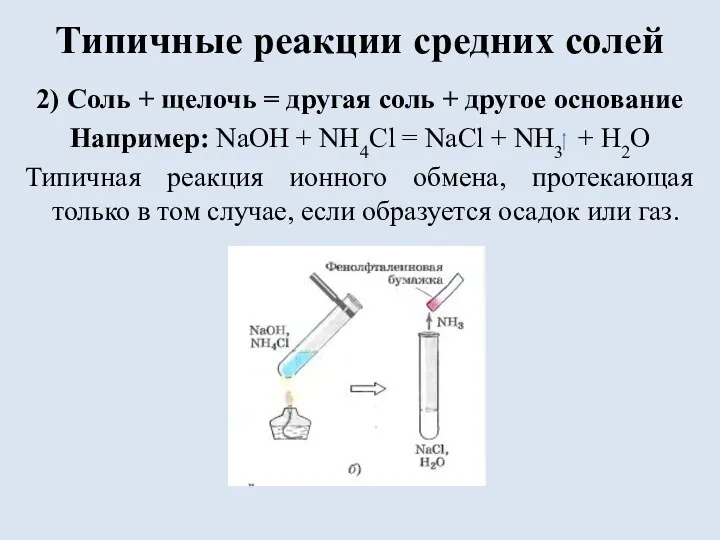
Типичные реакции средних солей
2) Соль + щелочь = другая соль +
другое основание
Например: NaOH + NH4Cl = NaCl + NH3 + H2O
Типичная реакция ионного обмена, протекающая только в том случае, если образуется осадок или газ.
Слайд 10

Типичные реакции средних солей
3) Соль1 + соль2 = соль3 +
соль4
Например: Na2SO4 + BaCl2 = BaSO4 +2NaCl
Типичная реакция ионного обмена, протекающая только в том случае, если образуется осадок.
Слайд 11

Типичные реакции средних солей
4) Соль + металл = другая соль +
другой металл
Например: CuSO4(p-p) + Fe = FeSO4 (p-p) + Cu
Правила: а) Каждый металл вытесняет из растворов солей все другие металлы, расположенные правее его в ряду напряжений;
б) обе соли (и реагирующая, и образующаяся в результате реакции) должны быть растворимыми;
в) металлы не должны взаимодействовать с водой, поэтому металлы главных подгрупп I и II группы ПС Д.И.Менделеева не вытесняют другие металлы из растворов солей.
Слайд 12

Обобщение темы
Тест «Как я запомнил тему»:
1) Выберите формулу соли:
а) HCl б) Ca(OH)2
в)
Na2SO4 г) MgО
2) Какая из приведенных солей растворима в воде:
а) AgCl б) MgS
в) FePO4 г) CuSO4
3) Какая из приведенных солей бескислородная:
а) CаSO4 б) KBr
в) NH4NO3 г) Na2CO3
Слайд 13

.
4) К какому типу солей относится данная соль - AlOHCl2:
а) средняя б)
основная
в) кислая г) ни к одной из этих
5) Какая реакция не является типичной реакцией для средних солей:
а) соль + металл б) соль + кислота
в) соль + оксид г) соль + щелочь












 Carbohydrates (sugars)
Carbohydrates (sugars) Дисперсные системы в атмосфере
Дисперсные системы в атмосфере Свинец — простое вещество, металл, химический элемент IV группы таблицы Менделеева
Свинец — простое вещество, металл, химический элемент IV группы таблицы Менделеева Фенолы: понятие, классификация, номенклатура, изомерия, получение, физические свойства, химические свойства, применение
Фенолы: понятие, классификация, номенклатура, изомерия, получение, физические свойства, химические свойства, применение Физические и химические явления. Условия течения и признаки химических реакций
Физические и химические явления. Условия течения и признаки химических реакций Алюминий. Строение
Алюминий. Строение Етери та естери. Хімічні властивості
Етери та естери. Хімічні властивості Азотовмисні та елементоорганічні сполуки
Азотовмисні та елементоорганічні сполуки Проведение лабораторных анализов образцов почвы
Проведение лабораторных анализов образцов почвы Коллигативные свойства растворов
Коллигативные свойства растворов Элементы теории горения
Элементы теории горения Physiology lab
Physiology lab Особенности выбора связующих и наполнителей для производства деталей машин из ПКМ
Особенности выбора связующих и наполнителей для производства деталей машин из ПКМ Высокомолекулярные соединения
Высокомолекулярные соединения Сахароза
Сахароза Физико-химия дисперсных систем. Физико-химия поверхностных явлений
Физико-химия дисперсных систем. Физико-химия поверхностных явлений Соединения железа
Соединения железа Рекомендации по оформлению развёрнутых ответов на задания ЕГЭ
Рекомендации по оформлению развёрнутых ответов на задания ЕГЭ Значение органической химии в жизни человека
Значение органической химии в жизни человека Степень окисления в органической химии
Степень окисления в органической химии Скорость химических реакций. Катализ. Химическое равновесие
Скорость химических реакций. Катализ. Химическое равновесие Ионная связь
Ионная связь Строение атома
Строение атома Ферменттер. Зерттелу тарихы
Ферменттер. Зерттелу тарихы Химиялық реакциялардың жылдамдығы
Химиялық реакциялардың жылдамдығы Происхождение рибосомы, белкового синтеза и генетического кода
Происхождение рибосомы, белкового синтеза и генетического кода Металлы. Общие свойства металлов
Металлы. Общие свойства металлов Химический элемент титан
Химический элемент титан