Содержание
- 2. ОСНОВЫ КИНЕТИКИ РЕАКЦИИ ГОРЕНИЯ
- 3. Это процесс химического взаимодействия топлива и окислителя характеризующийся: интенсивным выделении тепла скачкообразным ростом температуры и концентрации
- 4. КЛАССИФИКАЦИЯ РЕАКЦИЙ ГОРЕНИЯ
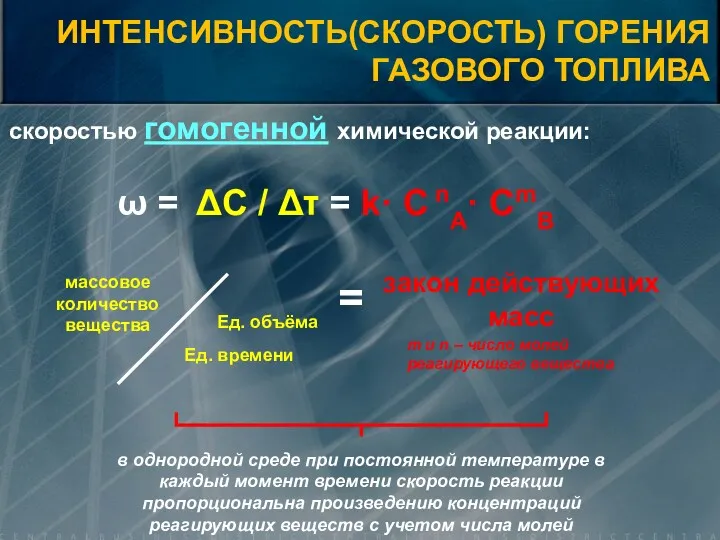
- 5. скоростью гомогенной химической реакции: ω = ΔС / Δτ = k· С nА· СmВ массовое количество
- 6. 2H2+O2=2H2O ω=k· С2H2· СO2 ИНТЕНСИВНОСТЬ(СКОРОСТЬ) ГОРЕНИЯ ГАЗОВОГО ТОПЛИВА
- 7. При данной температуре концентрация пропорциональна парциальному давлению соответствующего газа: ω=Kp· PnA· PmB ИНТЕНСИВНОСТЬ(СКОРОСТЬ) ГОРЕНИЯ ГАЗОВОГО ТОПЛИВА
- 8. При неизменной концентрации реагирующих веществ во времени (постоянный подвод топлива и окислителя в зону горения) скорость
- 9. Энергия активации Е - энергия достаточная для разрушения внутримолекулярных связей исходных веществ Энергия активации зависит от:
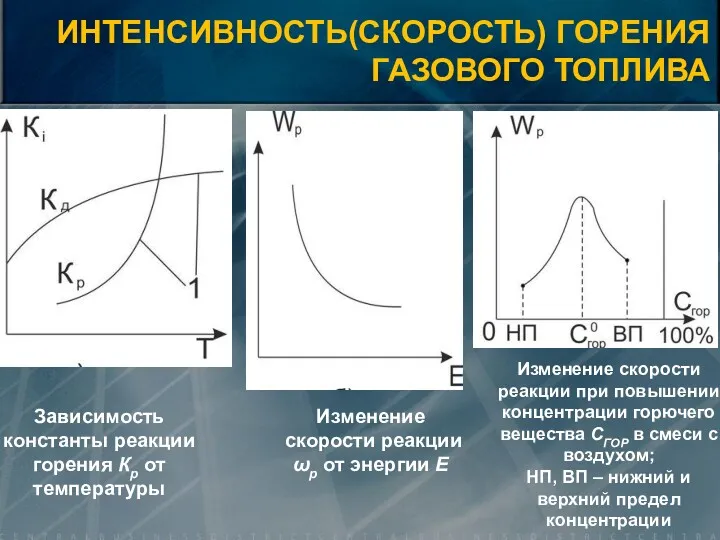
- 10. ИНТЕНСИВНОСТЬ(СКОРОСТЬ) ГОРЕНИЯ ГАЗОВОГО ТОПЛИВА Зависимость константы реакции горения Кр от температуры Изменение скорости реакции ωр от
- 11. ТЕМПЕРАТУРОЙ ВОСПЛАМЕНЕНИЯ Тепловыделение в ходе реакции горения топлива (при постоянной концентрации реагирующих веществ) определяется скоростью реакции
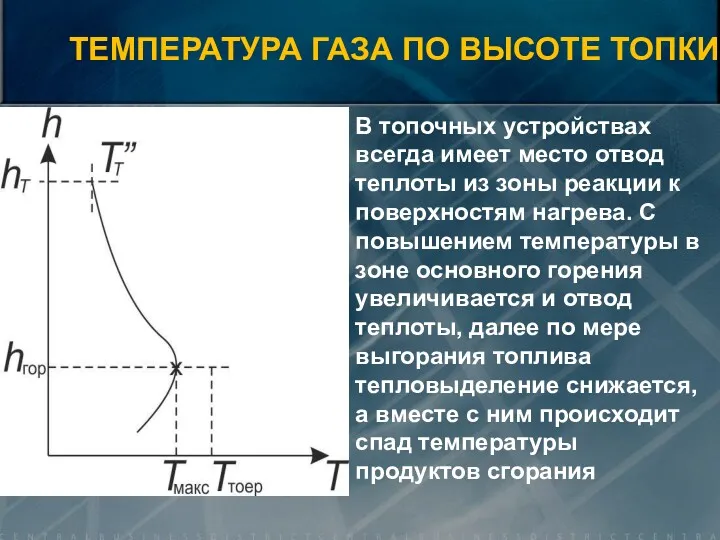
- 12. ТЕМПЕРАТУРА ГАЗА ПО ВЫСОТЕ ТОПКИ В топочных устройствах всегда имеет место отвод теплоты из зоны реакции
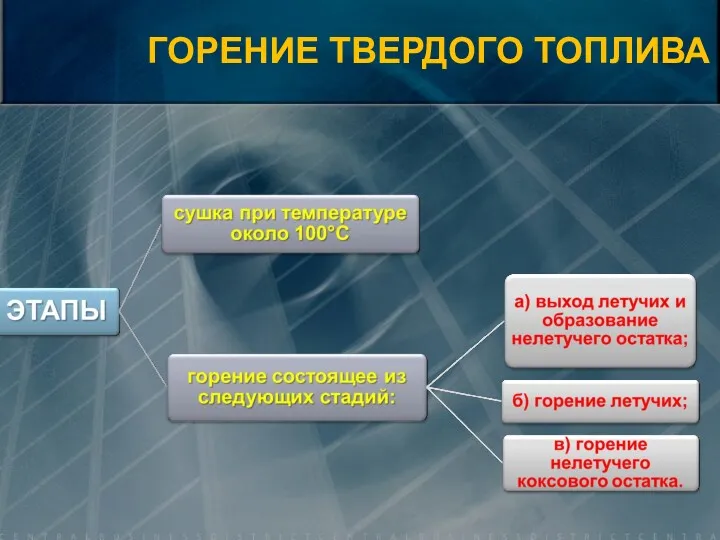
- 13. ГОРЕНИЕ ТВЕРДОГО ТОПЛИВА
- 14. ГОРЕНИЕ ТВЕРДОГО ТОПЛИВА
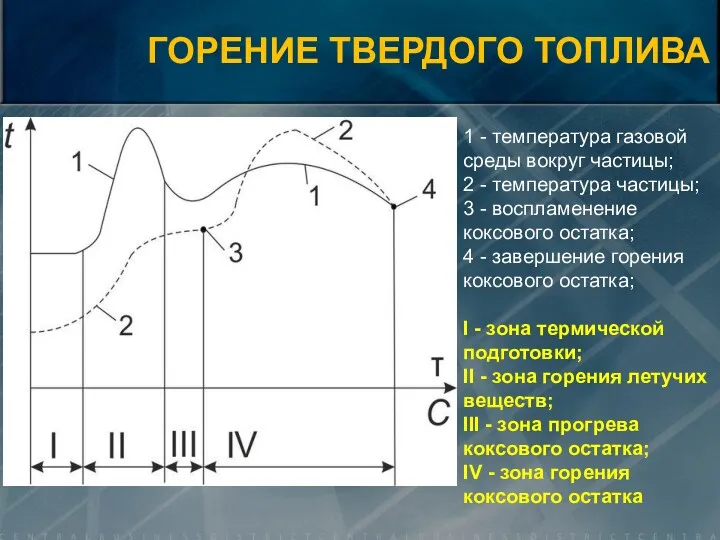
- 15. ГОРЕНИЕ ТВЕРДОГО ТОПЛИВА 1 - температура газовой среды вокруг частицы; 2 - температура частицы; 3 -
- 16. ГОРЕНИЕ ТВЕРДОГО ТОПЛИВА Горение летучих веществ занимает 0,2-0,5 с. и происходит при температуре 400-600 оС. Горение
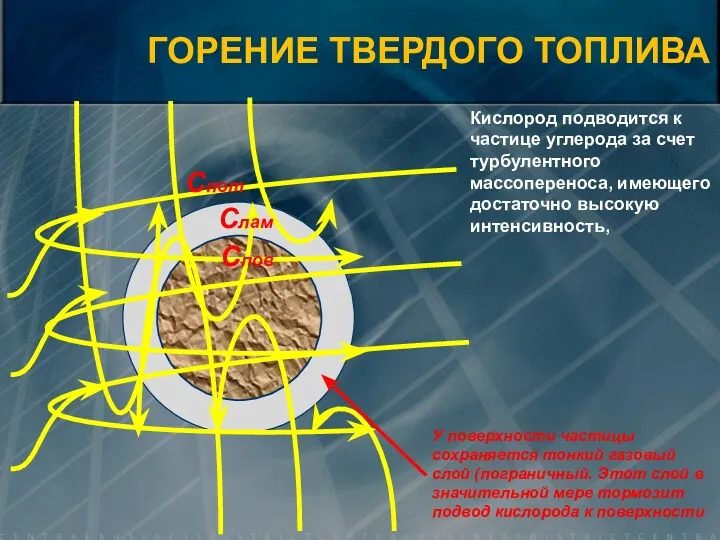
- 17. Спов Слам Спот Кислород подводится к частице углерода за счет турбулентного массопереноса, имеющего достаточно высокую интенсивность,
- 18. Скорость химической реакции зависит от скорости подвода кислорода к поверхности реагирования и от кинетики химической реакции.
- 19. . Количество подводимого к поверхности кислорода Константа скорости диффузии подвод кислорода к реагирующей поверхности твердого топлива
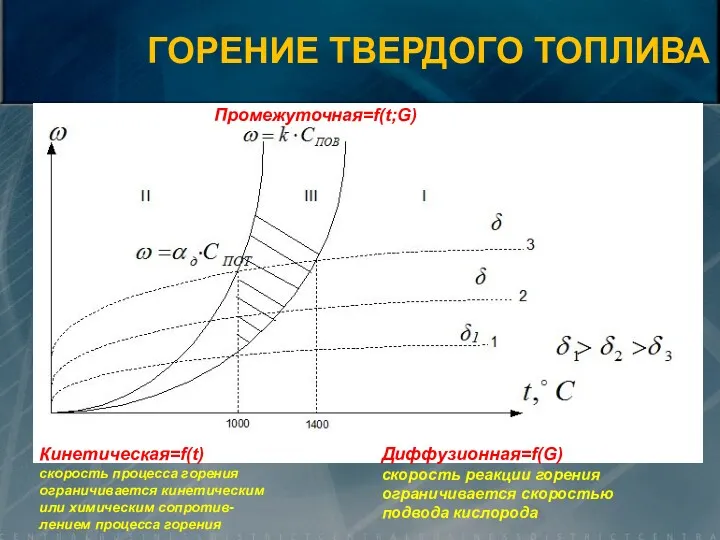
- 20. Кинетическая=f(t) скорость процесса горения ограничивается кинетическим или химическим сопротив-лением процесса горения Диффузионная=f(G) скорость реакции горения ограничивается
- 21. Область чисто диффузионного горения пылевидного топлива характерна для ядра факела, отличающегося наиболее высокой температурой горения, и
- 22. ГОРЕНИЕ ЖИДКОГО ТОПЛИВА
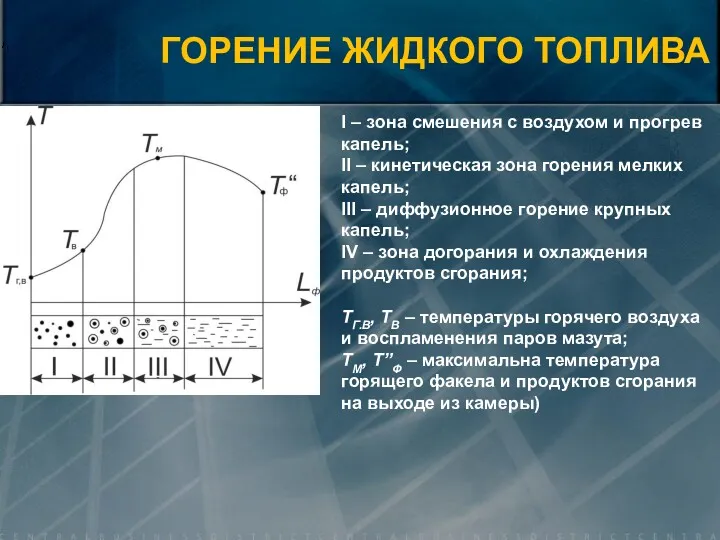
- 23. ГОРЕНИЕ ЖИДКОГО ТОПЛИВА при поступлении в зону высоких температур капля мазута вначале испаряется с поверхности за
- 24. ГОРЕНИЕ ЖИДКОГО ТОПЛИВА I – зона смешения с воздухом и прогрев капель; II – кинетическая зона
- 25. ГОРЕНИЕ ГАЗОВОГО ТОПЛИВА
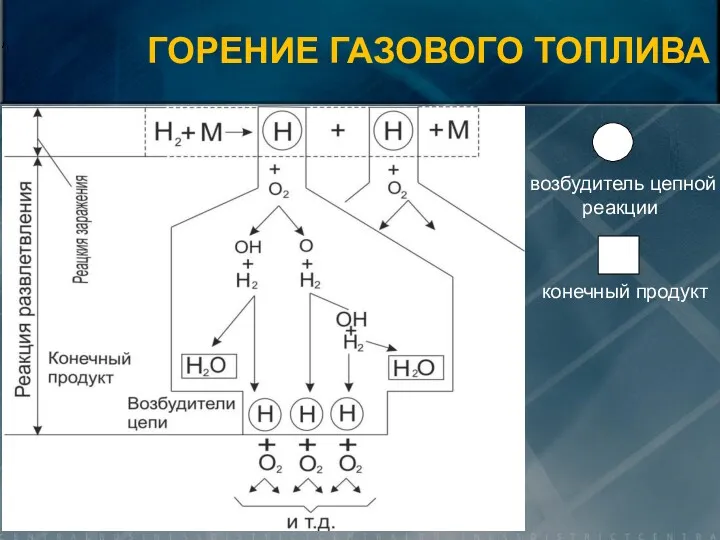
- 26. ГОРЕНИЕ ГАЗОВОГО ТОПЛИВА При горении газов протекают разветвленные реакции, в процессе которых один активный центр порождает
- 27. ГОРЕНИЕ ГАЗОВОГО ТОПЛИВА Цепная разветвленная реакция включает следующие процессы: Периодом индукции - накопления активных центров реакции
- 28. ГОРЕНИЕ ГАЗОВОГО ТОПЛИВА возбудитель цепной реакции конечный продукт
- 29. ГОРЕНИЕ ГАЗОВОГО ТОПЛИВА Трудность обеспечения полного смешения расхода газа с воздухом за короткий промежуток времени связан
- 30. МАТЕРИАЛЬНЫЙ БАЛАНС КОТЛА
- 31. V0 – это объем воздуха при нормальных условиях, который требуется для полного сгорания единицы топлива [нм3/кг]
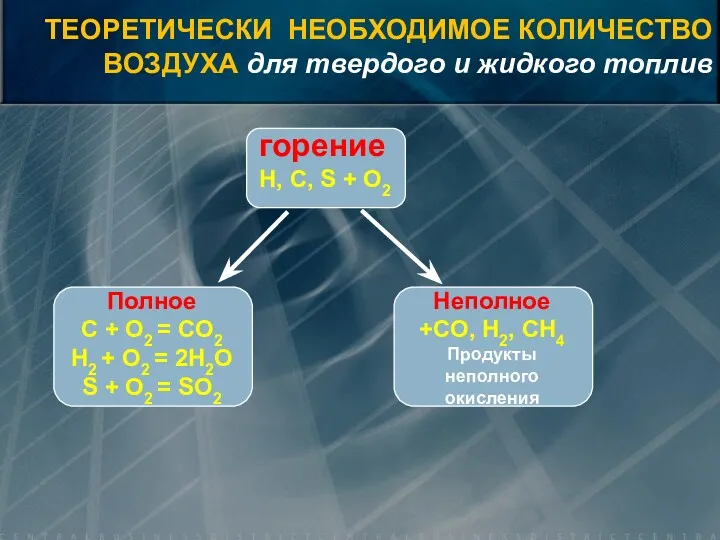
- 32. горение H, C, S + O2 Полное C + O2 = CO2 H2 + O2 =
- 33. C + O2 = CO2 12кг + 32кг = 44кг 1кг+32/12кг = 44/12кг 4H + O2
- 34. V0 = 100/21·V0O2 = 100/21·(GO2/ ρO2), где GO2 – вес О2 для окисления 1 кг топлива
- 35. V0=0,889· (CP+0,375·SЛР) + 0,265· HР – 0,033 · OР) [нм3/кг] V0 = 100/21·(GO2/ ρO2) C +
- 36. V0=0,889·(CP+0,375·SЛР) + 0,265· HР – 0,033 · OР) [нм3/кг] ТЕОРЕТИЧЕСКИ НЕОБХОДИМОЕ КОЛИЧЕСТВО ВОЗДУХА для твердого и
- 37. Для газообразного топлива состав горючих элементов выражается в процентах объёма 1 кмоль любого газа при нормальных
- 38. где H2, CO … – в процентах объема ТЕОРЕТИЧЕСКИ НЕОБХОДИМОЕ КОЛИЧЕСТВО ВОЗДУХА для газообразного топлива
- 39. Поскольку процесс перемешивания топлива с воздухом неидеален, то для обеспечения полного сгорания топлива, необходимо подавать воздуха
- 40. КОЭФФИЦИЕНТ ИЗБЫТКА ВОЗДУХА
- 41. При полном сгорании топлива и α=1: Vг0= VCO2 + VSO2 + V0N2 + V0H2 O =
- 42. [нм3/кг] Объем трехатомных газов: Объем азота: азот воздуха азот топлива ОПРЕДЕЛЕНИЕ ОБЪЕМОВ ПРОДУКТОВ СГОРАНИЯ для твердого
- 43. Объем водяных паров: окисление водорода влага топлива влага воздуха пар, при распыле мазута в форсунках V0H2O
- 44. При сжигании топлива с α>1: VГ = V0Г + (1 + 0,0161)·(α – 1)·V0 При химически
- 45. VRO2 = 0,01·(CO2 + СO + H2S + ∑(n·CnHm)) [нм3/нм3] V0N2 = 0,79·V0 + 0,01·N2 [нм3/нм3]
- 46. Приближенная углекислотная формула: ОПРЕДЕЛЕНИЕ КОЭФФИЦИЕНТА ИЗБЫТКА ВОЗДУХА α = RO2макс / RO2 Точная углекислотная формула: α
- 47. Значения α можно определить по результатам газового анализа продуктов сгорания. В простейшем случае, если содержанием азота
- 48. ЭНТАЛЬПИЯ ПРОДУКТОВ СГОРАНИЯ
- 49. Энтальпия продуктов сгорания при сжигании жидкого, газообразного и малозольного твердого топлива Н, кДж/кг или кДж/м3, является
- 50. При сжигании твердых топлив с высокой зольностью для расчета энтальпии продуктов сгорания сначала определяют значение приведенной
- 52. Скачать презентацию























![V0=0,889· (CP+0,375·SЛР) + 0,265· HР – 0,033 · OР) [нм3/кг]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/193236/slide-34.jpg)
![V0=0,889·(CP+0,375·SЛР) + 0,265· HР – 0,033 · OР) [нм3/кг] ТЕОРЕТИЧЕСКИ](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/193236/slide-35.jpg)




![[нм3/кг] Объем трехатомных газов: Объем азота: азот воздуха азот топлива](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/193236/slide-41.jpg)


![VRO2 = 0,01·(CO2 + СO + H2S + ∑(n·CnHm)) [нм3/нм3]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/193236/slide-44.jpg)





 Графен. Свойства и получение. Функционализация и применение композитов на его основе
Графен. Свойства и получение. Функционализация и применение композитов на его основе Оксиды. Классификация и химические свойства
Оксиды. Классификация и химические свойства Types of chemical reactions
Types of chemical reactions Роль хімії у розв`язанні екологічної проблеми
Роль хімії у розв`язанні екологічної проблеми Кислородосодержащие производные углеводородов. Спирты. Фенолы. Простые эфиры
Кислородосодержащие производные углеводородов. Спирты. Фенолы. Простые эфиры Химические свойства карбоновых кислот
Химические свойства карбоновых кислот Гидродинамические модели реакторов. Лекция № 2
Гидродинамические модели реакторов. Лекция № 2 Химическая и электрическая работа систем с химическими реакциями. Устройства для проведения электрохимических реакций
Химическая и электрическая работа систем с химическими реакциями. Устройства для проведения электрохимических реакций Этанол (эти́ловый спирт)
Этанол (эти́ловый спирт) Аминокислоты N H2 – C H – C O O H
Аминокислоты N H2 – C H – C O O H Проведення електрофоретичного розділення ДНК в агарозному гелі
Проведення електрофоретичного розділення ДНК в агарозному гелі Сырьевая база парфюмерно-косметической промышленности
Сырьевая база парфюмерно-косметической промышленности Оксиды. Формулы оксидов ( 8 класс)
Оксиды. Формулы оксидов ( 8 класс) Рідкі кристали та їх властивості
Рідкі кристали та їх властивості Химия нефти и газа. Лекция № 1
Химия нефти и газа. Лекция № 1 Оксиды. Классификация и химические свойства
Оксиды. Классификация и химические свойства Газовые смеси
Газовые смеси Превращение (S)-бутанол-2 в другие соединения
Превращение (S)-бутанол-2 в другие соединения Способы разделения смесей, применяемые в быту
Способы разделения смесей, применяемые в быту Щавелевая кислота
Щавелевая кислота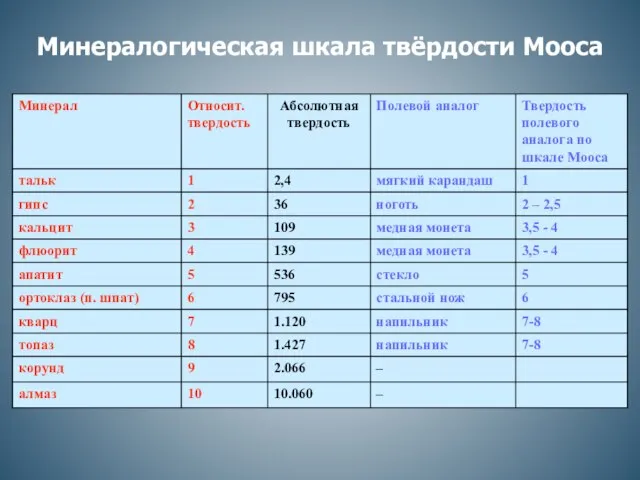 Минералогическая шкала твёрдости Мооса
Минералогическая шкала твёрдости Мооса Распределение элементов на Земле и в космосе
Распределение элементов на Земле и в космосе Волшебница - вода
Волшебница - вода Основы коррозии и защиты металлов. Методы исследования коррозии
Основы коррозии и защиты металлов. Методы исследования коррозии Химические реакции. Реакции обмена
Химические реакции. Реакции обмена Пептиды. Номенклатура и классификация пептидов. Особенности строения пептидной связи. Физические и химические свойства пептидов
Пептиды. Номенклатура и классификация пептидов. Особенности строения пептидной связи. Физические и химические свойства пептидов Жидкокристаллические индикаторы
Жидкокристаллические индикаторы Алкадиены. Химические свойства алкадиенов
Алкадиены. Химические свойства алкадиенов