Пептиды. Номенклатура и классификация пептидов. Особенности строения пептидной связи. Физические и химические свойства пептидов презентация
Содержание
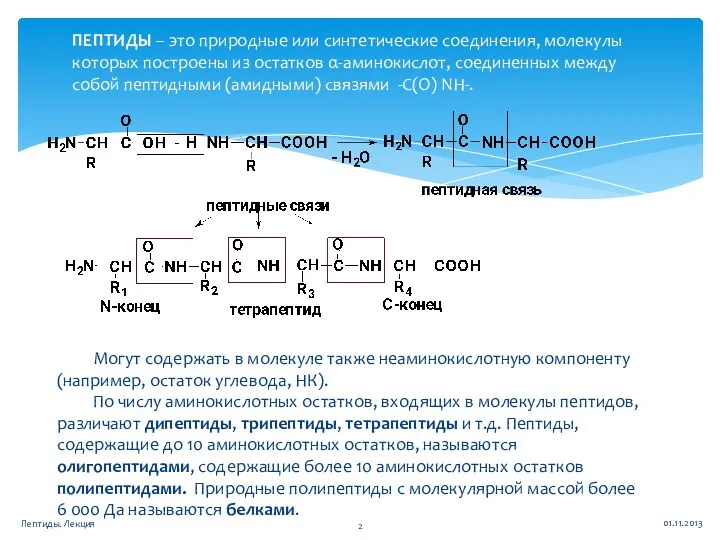
- 2. ПЕПТИДЫ – это природные или синтетические соединения, молекулы которых построены из остатков α-аминокислот, соединенных между собой
- 3. Впервые пептиды были выделены из ферментативных гидролизатов белков. Термин «пептиды» предложен Э. Фишером. Первый синтетический пептид
- 4. Важное достижение в этой области - разработанный в начале 50-х гг. P. Воганом и др. синтез
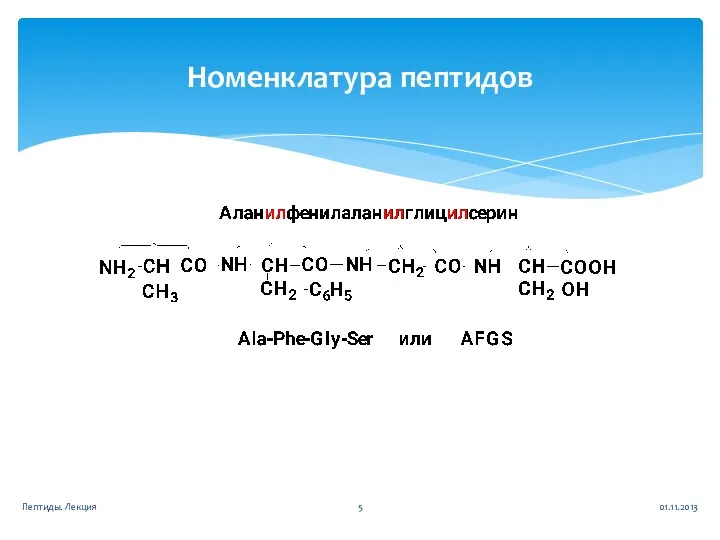
- 5. Номенклатура пептидов 01.11.2013 Пептиды. Лекция
- 6. Классификация пептидов Гомомерные пептиды при гидролизе образуют только аминокислоты, гетеромерные наряду с аминокислотами соеденения др. классов.
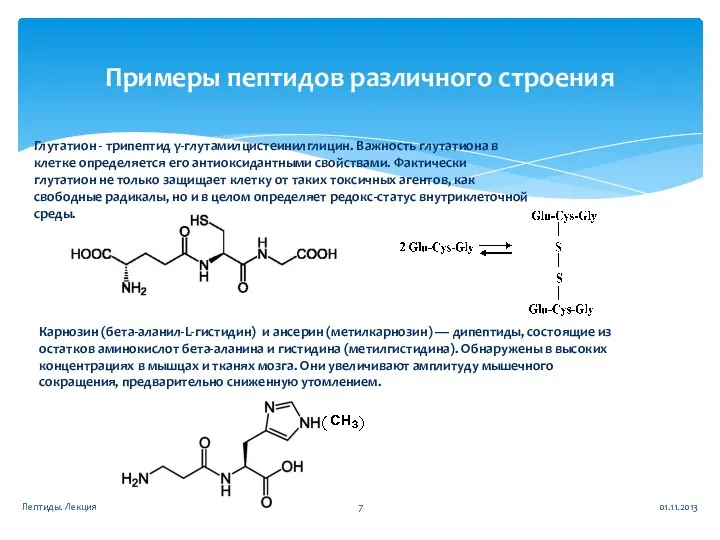
- 7. Примеры пептидов различного строения Глутатион - трипептид γ-глутамилцистеинилглицин. Важность глутатиона в клетке определяется его антиоксидантными свойствами.
- 8. Примеры пептидов различного строения Энкефалины – нейропептиды с морфиноподобным действием, вырабатываемые центральной нервной системой позвоночных. Уменьшают
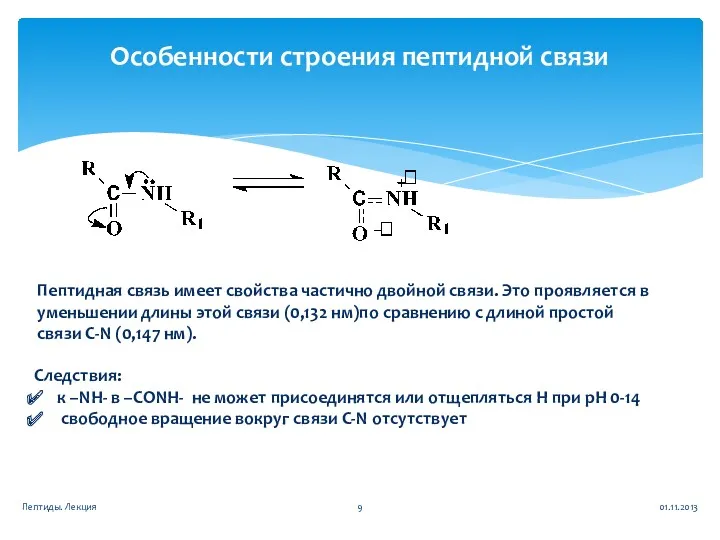
- 9. Особенности строения пептидной связи Следствия: к –NH- в –CONH- не может присоединятся или отщепляться Н при
- 10. Свойства пептидов Олигопептиды по свойствам близки к аминокислотам, полипептиды подобны белкам. Олигопептиды представляют собой, как правило,
- 11. Химические свойства пептидов Химические свойства олигопептидов определяются содержащимися в них функциональными группами, а также особенностями пептидной
- 12. В организме: каскадные процессы рибосомальный синтез нерибосомальный синтез (пантотеновая к-та и фосфопантотеин) – у микроорганизмов Вне
- 13. Регуляция кровяного давления: Ангиотензин-2 — олигопептидный гормон, который вызывает вазоконстрикцию (сужение сосудов), повышение кровяного давления и
- 14. Строение пантотеновой кислоты Пантотеновая кислота (Витамин B5) - белый мелкокристаллический порошок, хорошо растворимый в воде. Она
- 15. Химический синтез пептидов Три аминокислотных остатка могут дать 6 трипептидов с различными аминокислотами в составе, четыре
- 16. Защитные группы Все защитные группы делят на N-защитные (для временной защиты группы NH2), С-защитные (для временной
- 17. Метод активированных эфиров: основан на предварительном образовании сложноэфирного производного карбоксильной компоненты путем введения в нее спиртового
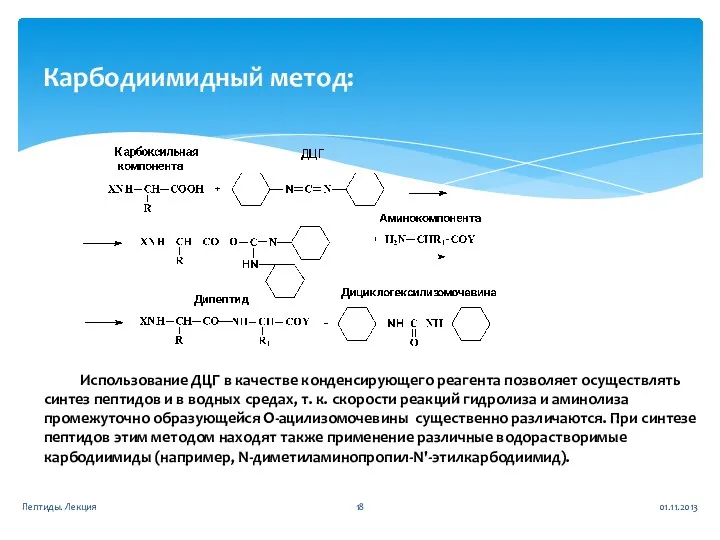
- 18. 01.11.2013 Пептиды. Лекция Карбодиимидный метод: Использование ДЦГ в качестве конденсирующего реагента позволяет осуществлять синтез пептидов и
- 19. 01.11.2013 Пептиды. Лекция Метод смешанных ангидридов: В одном из вариантов метода смешанных ангидридов в качестве конденсирующего
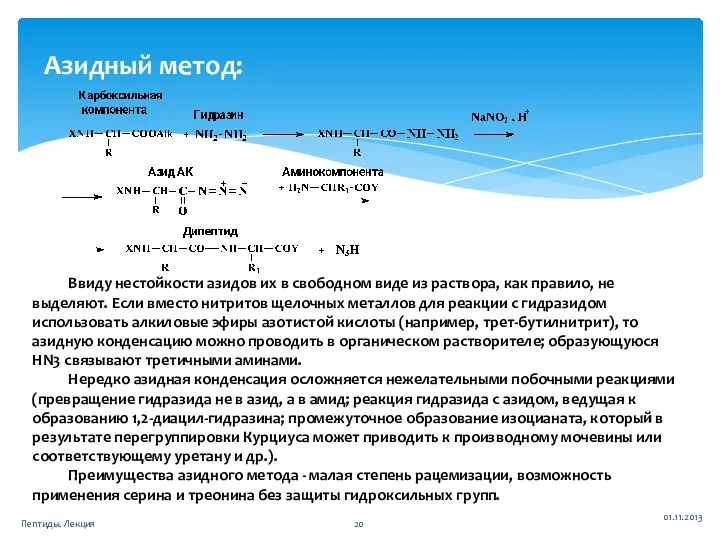
- 20. 01.11.2013 Пептиды. Лекция Азидный метод: Ввиду нестойкости азидов их в свободном виде из раствора, как правило,
- 21. 01.11.2013 Пептиды. Лекция Рацемизация при синтезе пептидов: Наиболее важные способы исключения рацемизации: Наращивание пептидной цепи в
- 22. Для превращения защищенных пептидов в свободные используют специальные методы деблокирования, которые основаны на реакциях, обеспечивающих отщепление
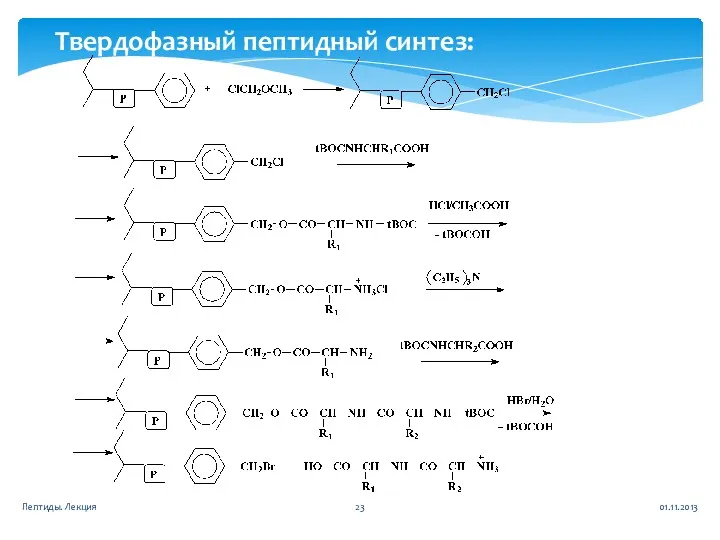
- 23. 01.11.2013 Пептиды. Лекция Твердофазный пептидный синтез:
- 25. Скачать презентацию















 Процессы проявления и фиксирования
Процессы проявления и фиксирования Периодическая система химических элементов. Периоды
Периодическая система химических элементов. Периоды Непредельные углеводороды: общая характеристика
Непредельные углеводороды: общая характеристика Көмірсутектерді пиролиздеу арқылы қарапайым олефиндерді алу
Көмірсутектерді пиролиздеу арқылы қарапайым олефиндерді алу Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Растворимость веществ в воде. Растворы. 8 класс
Растворимость веществ в воде. Растворы. 8 класс Валентность химических элементов
Валентность химических элементов Химическое равновесие. Принцип Ле Шателье
Химическое равновесие. Принцип Ле Шателье Закономірності протікання хімічних реакцій
Закономірності протікання хімічних реакцій Атомы, молекулы и ионы
Атомы, молекулы и ионы Химия нефти и газа
Химия нефти и газа Кислород
Кислород Відкриття та походження хімічних елементів
Відкриття та походження хімічних елементів Чистые вещества и смеси (продолжение)
Чистые вещества и смеси (продолжение) Кондуктометрия. Кондуктометрия әдісі. Электрохимиялық әдістер
Кондуктометрия. Кондуктометрия әдісі. Электрохимиялық әдістер Поліметилметакрилат
Поліметилметакрилат Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Хімія у побуті
Хімія у побуті Алкадиены
Алкадиены Коррозия металлов и способы защиты от неё
Коррозия металлов и способы защиты от неё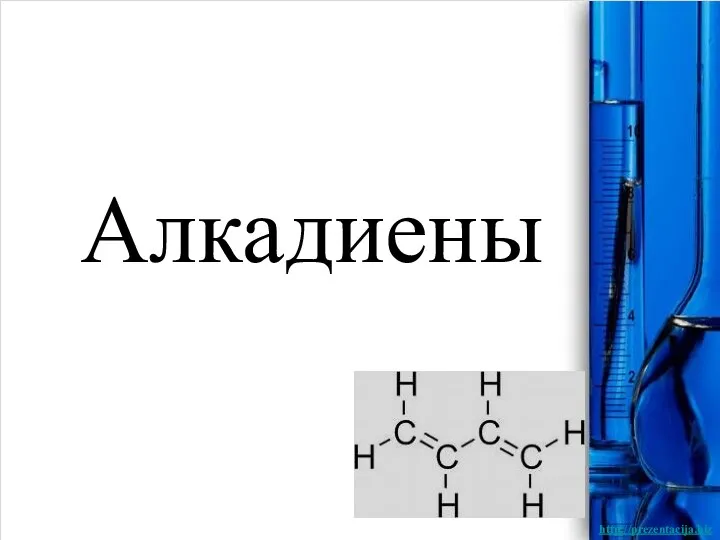 Алкадиены
Алкадиены Закон сохранения массы веществ
Закон сохранения массы веществ Полимеры. Пластмассы. Волокна
Полимеры. Пластмассы. Волокна Методы количественного определения. Химические методы анализа
Методы количественного определения. Химические методы анализа Техники ювелирного дела. Введение в предмет. Общие сведения
Техники ювелирного дела. Введение в предмет. Общие сведения Vitaminele
Vitaminele Пробоотбор других ООС. Лекция 3
Пробоотбор других ООС. Лекция 3 Химический состав клетки. Неорганические вещества клетки. Урок 1
Химический состав клетки. Неорганические вещества клетки. Урок 1