Содержание
- 2. Скорость химических реакций - Это изменение концентрации одного из реагирующих или одного из продуктов реакции в
- 3. Химические реакции Гомогенные - реагирующие вещества и продукты реакции находятся в одной фазе 2SO2 (г) +
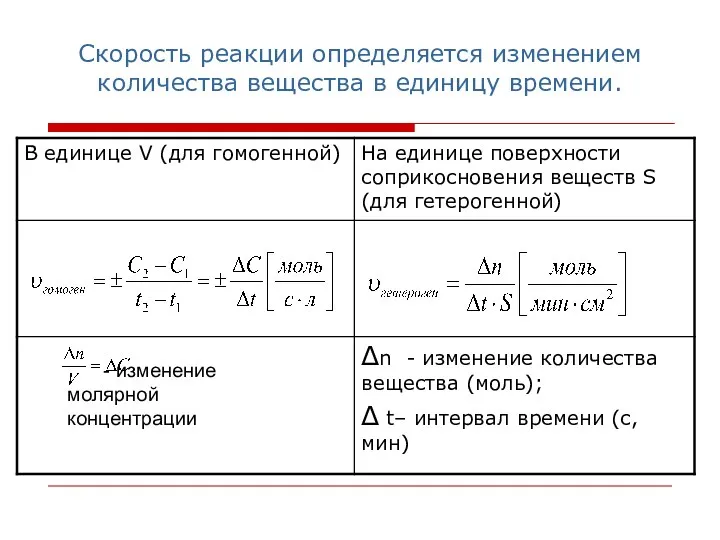
- 4. Скорость реакции определяется изменением количества вещества в единицу времени. - изменение молярной концентрации
- 5. Задача на применение знаний по «Скорости химических реакций» Химическая реакция протекает в растворе, согласно уравнению: А+В
- 6. Самопроверка.
- 7. Задача на применение знаний по «Скорости химических реакций» В некоторый момент времени концентрация хлора Cl2 в
- 8. Самопроверка.
- 9. Факторы, влияющие на скорость химической реакции природа реагирующих веществ; температура; концентрация реагирующих веществ; действие катализаторов; поверхность
- 10. Теория столкновений. Основная идея её такова: реакции происходят при столкновении частиц реагентов, которые обладают определённой энергией.
- 11. 1. Природа реагирующих веществ. Под природой реагирующих веществ понимают их состав, строение, взаимное влияние атомов в
- 12. Задание на применение знаний Объясните разную скорость взаимодействия цинка и магния с уксусной кислотой; цинка с
- 13. 2. Температура При увеличении температуры на каждые 10° С общее число столкновений увеличивается только на ~
- 14. Задача на применение знаний: Определите, как изменится скорость некоторой реакции: а) при повышении температуры от 10°
- 15. Самопроверка а) подставить данные задачи в формулу: скорость реакции увеличится в 81 раз. б) Скорость реакции
- 16. 3. Концентрации реагирующих веществ. На основе большого экспериментального материала в 1867 г. норвежские учёные К. Гульдберг,
- 17. Математическое выражение закона действующих масс. По закону действующих масс скорость реакции, уравнение которой А+В=С может быть
- 18. Задача на применение знаний: Составьте кинетические уравнения для следующих реакций: А) H2+I2=2HI Б) S + O2
- 19. Задача на применение знаний: Как изменится скорость реакции, имеющей кинетическое уравнение v= kCA2 CB, если: а)
- 20. Самопроверка. Решение. Подставим соответствующие данные в кинетическое уравнение, сравним скорости реакций. скорость реакции увеличится в 9
- 21. 4. Действие катализатора Обсуждение вопросов: 1.Что такое катализатор и каталитические реакции? 2. Приведите примеры известных вам
- 22. 5.Поверхность соприкосновения реагирующих веществ. Скорость реакции увеличивается благодаря: -увеличению площади поверхности соприкосновения реагентов (измельчение); -повышению реакционной
- 23. Домашнее задание п. 15, упр. 11, с. 136
- 25. Скачать презентацию





















 Галогены. Фтор, хлор, бром, йод, астат
Галогены. Фтор, хлор, бром, йод, астат Пропилен-алкены(пропен)
Пропилен-алкены(пропен) Теория строения органических соединений
Теория строения органических соединений Электролитическая диссоциация. Реакции ионного обмена
Электролитическая диссоциация. Реакции ионного обмена 20230205_okislitelno-_vosstanovitelnye_reaktsii
20230205_okislitelno-_vosstanovitelnye_reaktsii Скорость химических реакций. Катализ. Химическое равновесие
Скорость химических реакций. Катализ. Химическое равновесие Соли. Классификация. Физические и химические свойства солей
Соли. Классификация. Физические и химические свойства солей Current Condition(Revision C)
Current Condition(Revision C) Состояние электронов в атоме
Состояние электронов в атоме Измерение и оценка химического фактора. Лекция 9
Измерение и оценка химического фактора. Лекция 9 Фосфор и его соединения
Фосфор и его соединения Прочность полимеров
Прочность полимеров Скорость химических реакций. Химическое равновесие
Скорость химических реакций. Химическое равновесие Бензол молекуласында байланыстардың түзілу сызбанұсқасы
Бензол молекуласында байланыстардың түзілу сызбанұсқасы Полімери. Їх властивості та застосування
Полімери. Їх властивості та застосування Периодический закон Д.И. Менделеева
Периодический закон Д.И. Менделеева Щелочные металлы
Щелочные металлы Типы эмульсий. Фракционный состав нефти. Типы нефти
Типы эмульсий. Фракционный состав нефти. Типы нефти Счастливый случай. Право первого хода
Счастливый случай. Право первого хода Газообразные вещества
Газообразные вещества Химическая коррозия. Методы защиты от химической коррозии
Химическая коррозия. Методы защиты от химической коррозии Алкины. Гомологический ряд
Алкины. Гомологический ряд Теория строения органического вещества. 10 класс
Теория строения органического вещества. 10 класс Самое удивительное на свете вещество - вода
Самое удивительное на свете вещество - вода АЛКАНЫ Строение молекулы метана.
АЛКАНЫ Строение молекулы метана. Сапалық талдау. Сапалық аналитикалық реакциялар
Сапалық талдау. Сапалық аналитикалық реакциялар Кислород. Химия. 8 класс
Кислород. Химия. 8 класс Физические свойства металлов
Физические свойства металлов