Содержание
- 2. Великие законы мирозданья В сущности наивны и просты. И порой Вам не хватает знания Для разгадки
- 3. ОТКРЫТИЕ ЩЕЛОЧНЫХ МЕТАЛЛОВ Литий был открыт шведским химиком Й. Арфведсоном в 1817 г. По предложению Й.Берцелиуса
- 4. Натрий и калий были впервые получены английским химиком и физиком Г. Дэви в 1807г при электролизе
- 5. Й. Берцелиус предложил назвать один новый элемент натрием (от араб. натрун – сода), а второй элемент
- 6. Рубидий был открыт по характерным линиям в длинноволновой области спектра в 1861г. немецкими учёными Р. Бунзеном
- 7. Цезий был первым элементом, открытым с помощью метода спектрального анализа. В 1860 г Р. Бунзен и
- 8. Франций был открыт в 1939г француженкой М. Пере. Она доказала, что этот элемент является продуктом распада
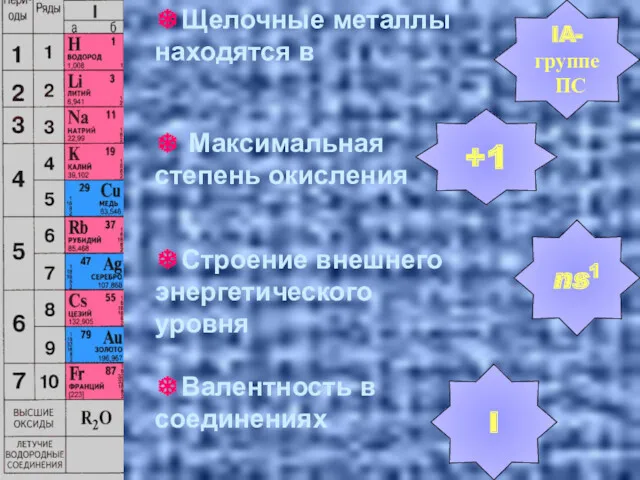
- 9. ❄Щелочные металлы находятся в ❄Строение внешнего энергетического уровня ❄ Максимальная степень окисления +1 ns1 IA-группе ПС
- 10. В РЯДУ ЩЕЛОЧНЫХ МЕТАЛЛОВ Na K Li Fr r атомов увеличивается увеличиваются восст. св-ва уменьшение tпл.
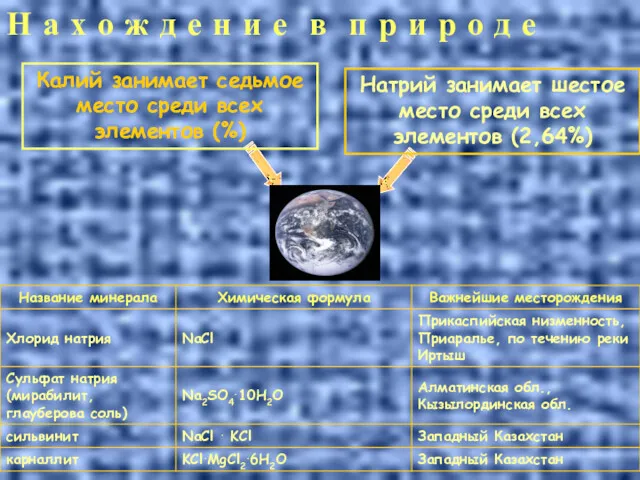
- 11. Содержание щелочных металлов в природе
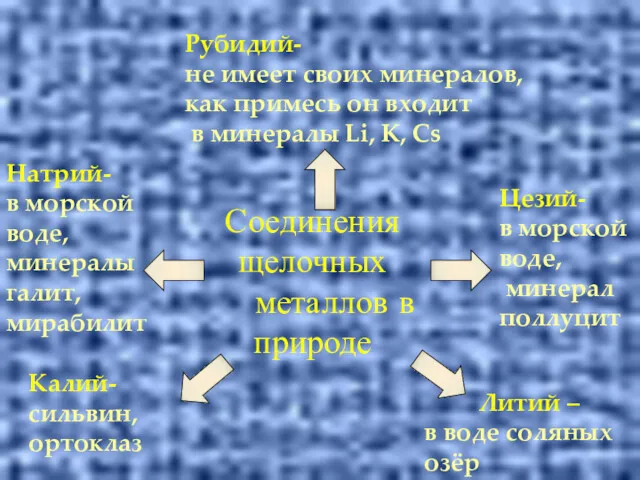
- 12. Соединения щелочных металлов в природе Литий – в воде соляных озёр Натрий- в морской воде, минералы
- 13. Н а х о ж д е н и е в п р и р о
- 14. Минералы натрия и калия NaСl, галит КСl, сильвин
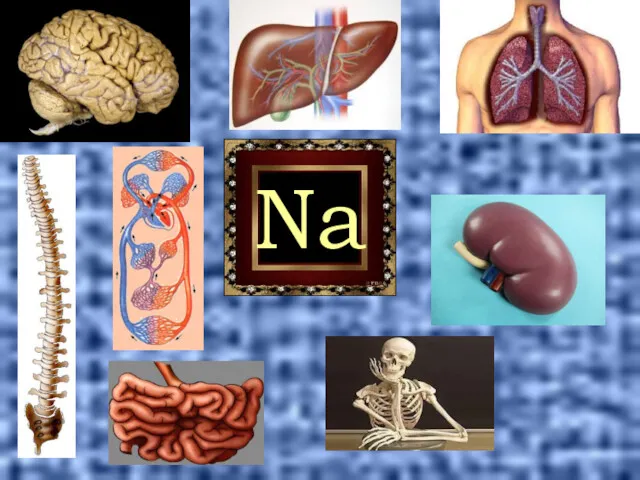
- 15. Б и о л о г и ч е с к а я р о л
- 16. Содержание ионов щелочных металлов в человеческом организме Na 0,08% K 0,23% Li 10 % Rb 10
- 17. Na
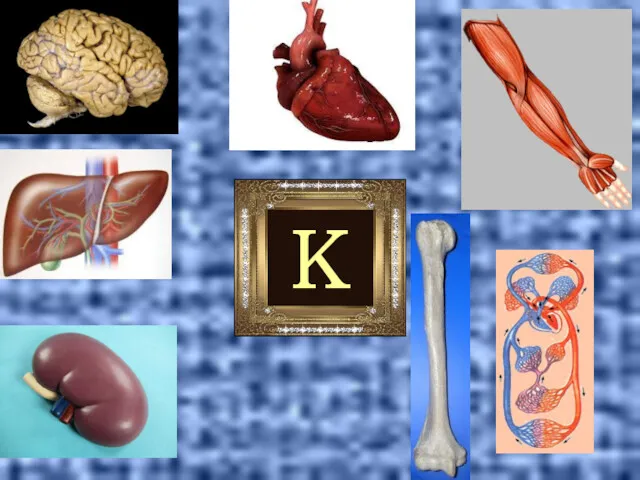
- 18. К
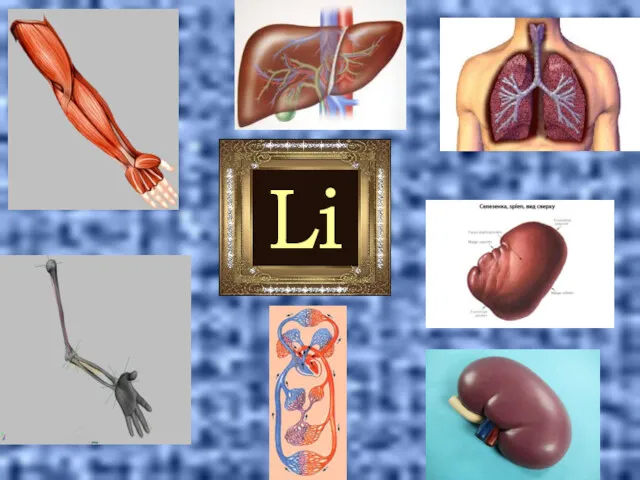
- 19. Li
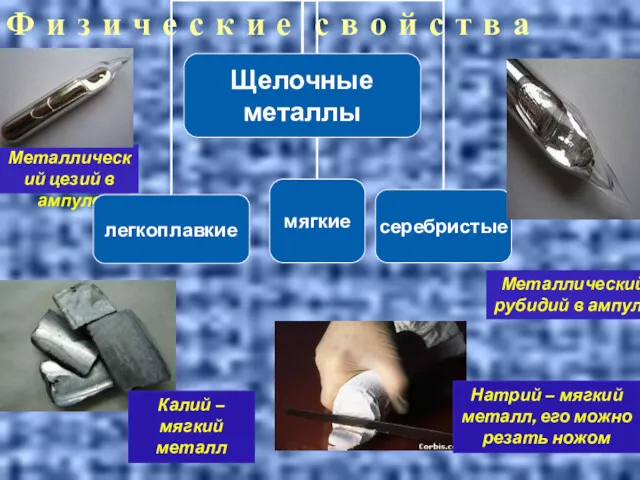
- 20. Металлический цезий в ампуле Металлический рубидий в ампуле Натрий – мягкий металл, его можно резать ножом
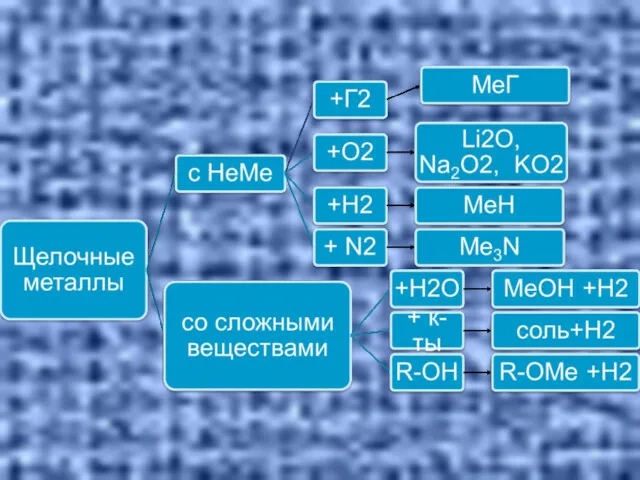
- 21. Х И М И Ч Е С К И Е С В О Й С Т
- 22. Все щелочные металлы активно реагируют с водой, образуя щелочи и восстанавливая воду до водорода: 2М0 +
- 24. Окраска пламени ионами щелочных металлов Li+ Rb+ Na+ Cs+ К+ Li+ - карминово-красный K+ - фиолетовый
- 25. Химические свойства оксидов Оксиды щелочных металлов обладают всеми свойствами, присущими основным оксидам: они реагируют с водой,
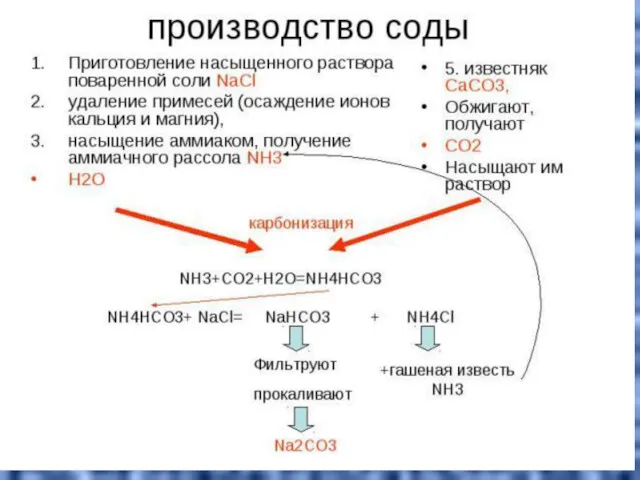
- 29. Сода NH3 + CO2 + H2O + NaCl → NaHCO3 + NH4Cl.
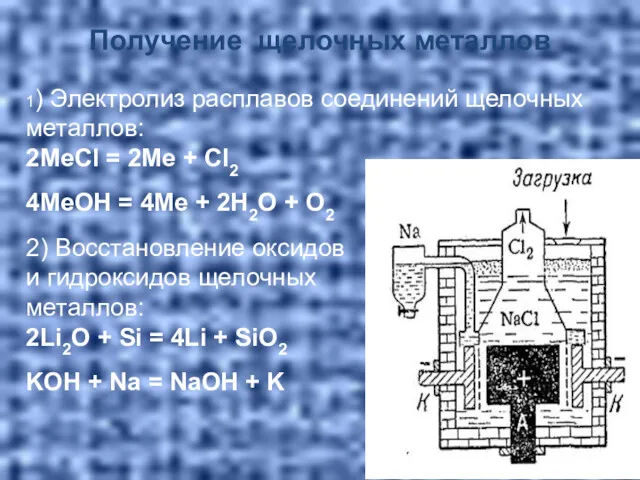
- 31. Получение щелочных металлов 1) Электролиз расплавов соединений щелочных металлов: 2МеCl = 2Ме + Cl2 4МеOH =
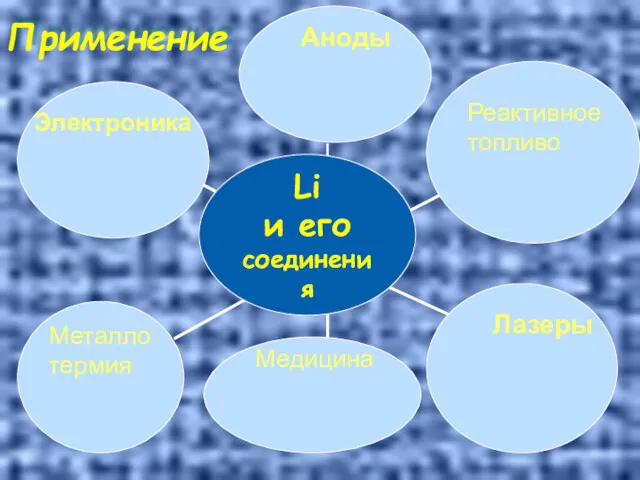
- 32. Применение Аноды Реактивное топливо Лазеры Медицина Электроника Металло термия
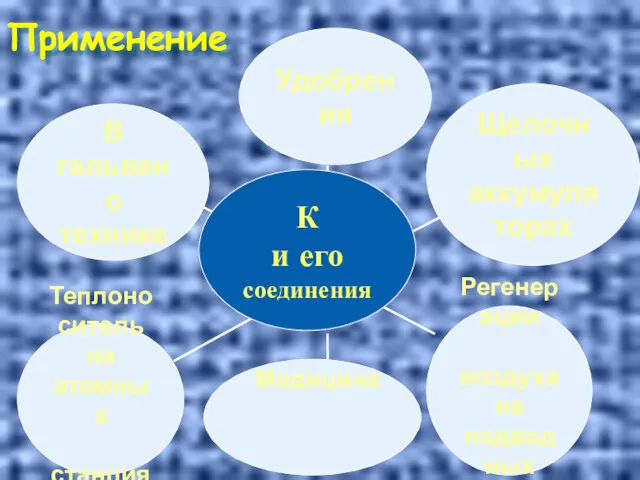
- 33. Применение Консервир. средство Медицина
- 34. Применение Медицина
- 35. Применение
- 36. Применение
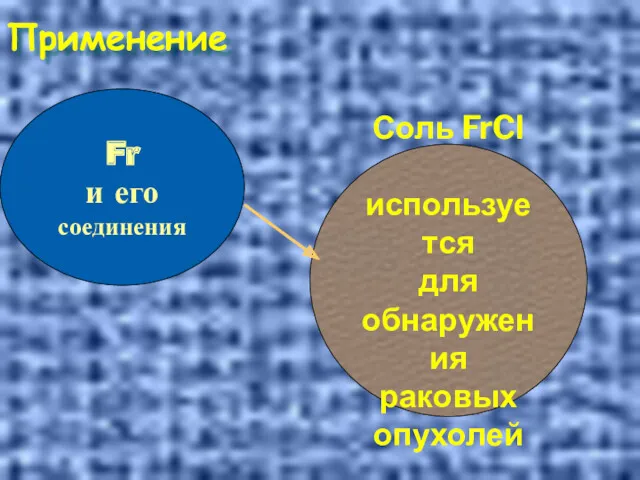
- 37. Применение Fr и его соединения Соль FrCl используется для обнаружения раковых опухолей
- 38. Щелочные металлы - серебристо–белые вещества, за исключением цезия - серебристо-желтого цвета, с металлическим блеском. Все щелочные
- 40. Скачать презентацию






















 Основні закони хімії.Класи та номенклатура неорганічних сполук
Основні закони хімії.Класи та номенклатура неорганічних сполук Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Кристалдардың ішкі құрылымы
Кристалдардың ішкі құрылымы Аминокислоты. Понятие аминокислот
Аминокислоты. Понятие аминокислот Сложные эфиры. Жиры
Сложные эфиры. Жиры Кислород
Кислород Дисперсные системы
Дисперсные системы Алканы. Пропан - С3Н8
Алканы. Пропан - С3Н8 Классификация органических соединений
Классификация органических соединений Химические элементы азот и фосфор
Химические элементы азот и фосфор Нанокомпозттерді алу жолдары
Нанокомпозттерді алу жолдары Коллигативные свойства растворов
Коллигативные свойства растворов Получение полимеров из низкомолекулярных соединений
Получение полимеров из низкомолекулярных соединений Теория твердения минеральных вяжущих веществ
Теория твердения минеральных вяжущих веществ Курс хімії за 11 клас
Курс хімії за 11 клас Непредельные углеводороды: этилен
Непредельные углеводороды: этилен Простые вещества - металлы
Простые вещества - металлы Современные конструкционные материалы
Современные конструкционные материалы Кислотність та основність органічних сполук
Кислотність та основність органічних сполук Виды химической связи
Виды химической связи Аминокислоты. Белки
Аминокислоты. Белки Биологически важные гетероциклы
Биологически важные гетероциклы Theories of acids and bases. Ionic equilibria in electrolyte solutions. Buffer solutions (topic 3.4)
Theories of acids and bases. Ionic equilibria in electrolyte solutions. Buffer solutions (topic 3.4) Использование методов проблемного обучения на уроках химии
Использование методов проблемного обучения на уроках химии Общая характеристика неметаллов
Общая характеристика неметаллов Химия в искусстве
Химия в искусстве Минералы. Химическая классификация
Минералы. Химическая классификация Натрий алкилсульфонаттарын алу. №4 лекция
Натрий алкилсульфонаттарын алу. №4 лекция