Содержание
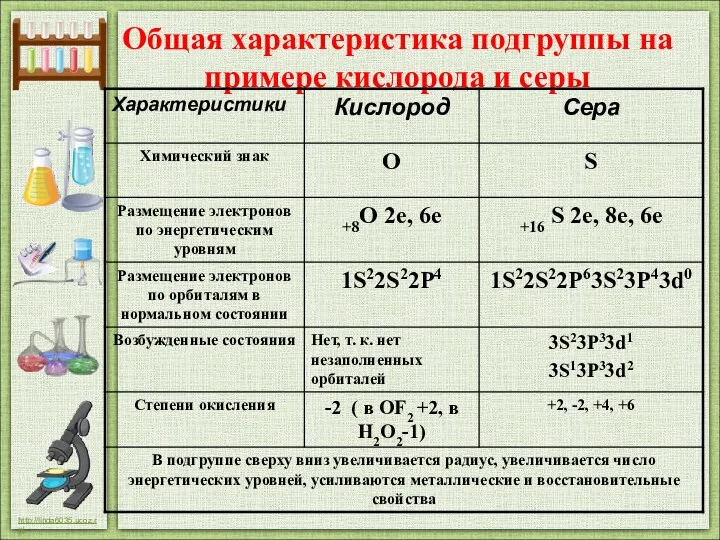
- 2. Общая характеристика подгруппы на примере кислорода и серы
- 3. Я.Берцелиус К И С Л О Р О Д– это вещество, вокруг которого вращается вся земная
- 4. В 1750 году М.В.Ломоносов на основании своих опытов доказал, что в состав воздуха входит вещество, окисляющее
- 5. Кислород был открыт английским химиком Джозефом ПристлиДжозефом Пристли 1 августаДжозефом Пристли 1 августа 1774 года путём
- 6. В 1771 году – это вещество было получено шведским химиком Карлом Вильгельмом Шееле. Он прокаливал селитру
- 7. Лавуазье Антуан Лоран в 1775 году установил, что кислород входит в состав воздуха и содержится во
- 8. 1. Элемент кислород находится в VI группе, главной подгруппе, II периоде, порядковый номер №8, Ar =
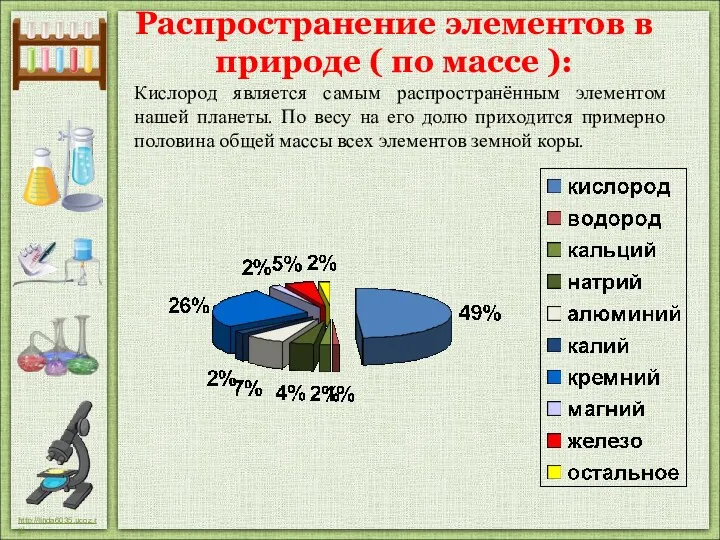
- 9. 5. В земной коре его 49% по массе, в гидросфере – 89% по массе. 6. В
- 10. Распространение элементов в природе ( по массе ): Кислород является самым распространённым элементом нашей планеты. По
- 11. Способы получения и собирания кислорода. А) В природе: Кислород в природе образуется в процессе фотосинтеза. 6СО2
- 12. Б) В промышленности: Перегонкой сжиженного воздуха при t = - 1830 С под давлением. В) В
- 13. Д) некоторых высших оксидов: 4CrO3= 2Cr2O3 + 3О2; 2PbO2 = 2PbO + О2; 3MnO2 = Mn3O4
- 14. Способы получения и собирания кислорода. ж) перманганата калия при нагревании: 2KMnO4 –t°→ K2MnO4 + MnO2 +
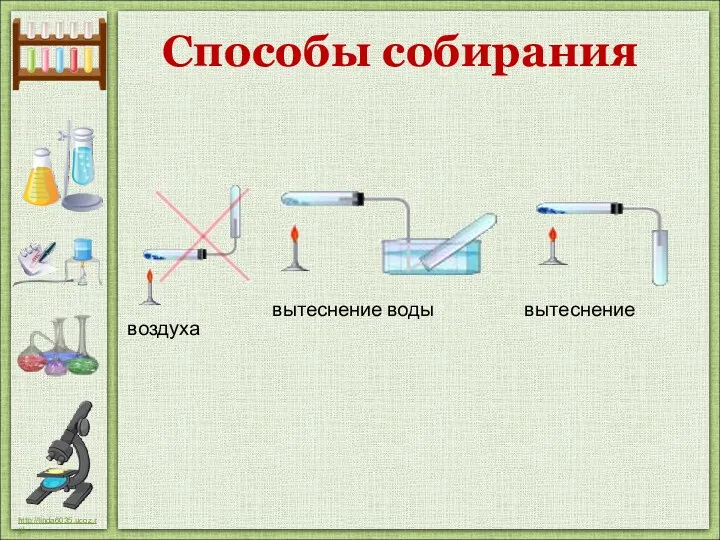
- 15. Способы собирания вытеснение воды вытеснение воздуха
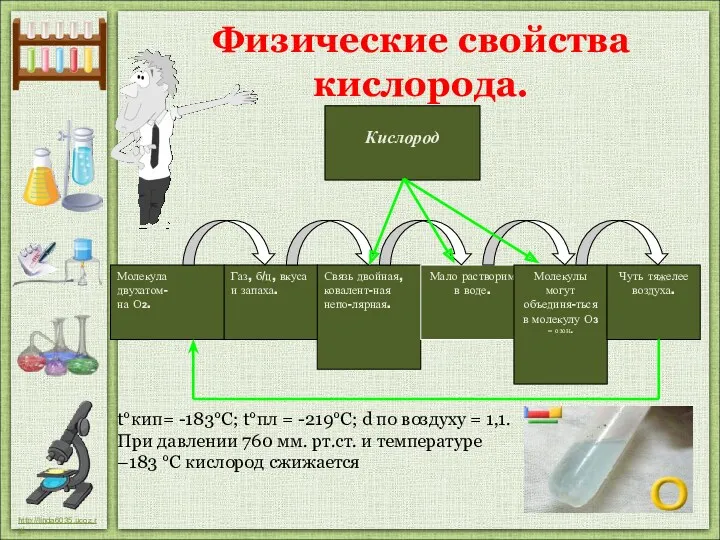
- 16. Физические свойства кислорода. t°кип= -183°С; t°пл = -219°C; d по воздуху = 1,1. При давлении 760
- 17. Аллотропия- существование какого-либо элемента в виде нескольких простых веществ.
- 18. Взаимодействие веществ с кислородом называется окислением. С кислородом реагируют все элементы, кроме Au, Pt, He, Ne
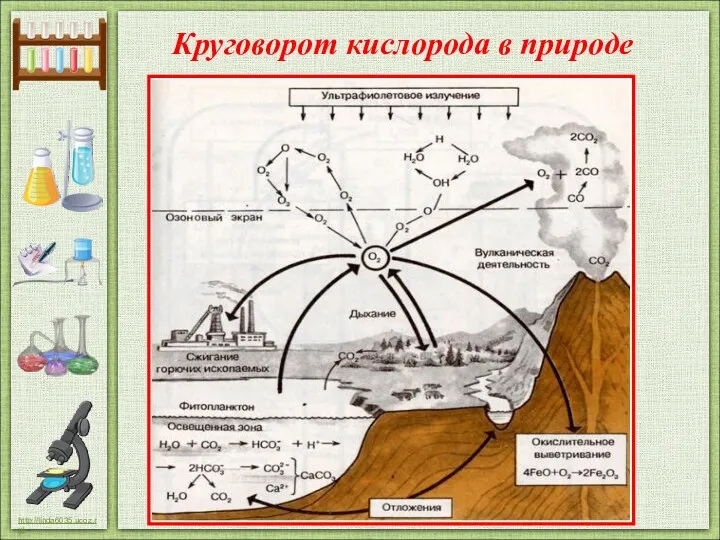
- 19. Круговорот кислорода в природе
- 20. Находит широкое применение в медицине и промышленности. При высотных полётах лётчиков снабжают специальными приборами с кислородом.
- 22. Скачать презентацию














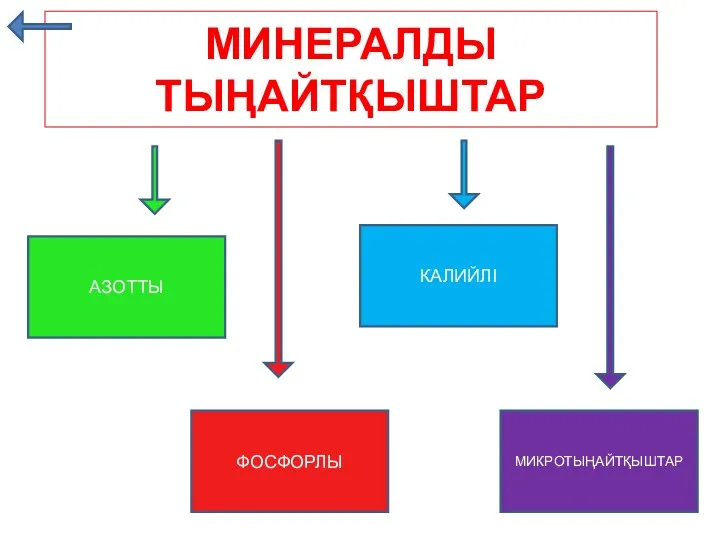 Минералды тыңайтқыштар
Минералды тыңайтқыштар Тотығу-тотықсыздану титрлеу әдісі
Тотығу-тотықсыздану титрлеу әдісі Пены. Пенообразование
Пены. Пенообразование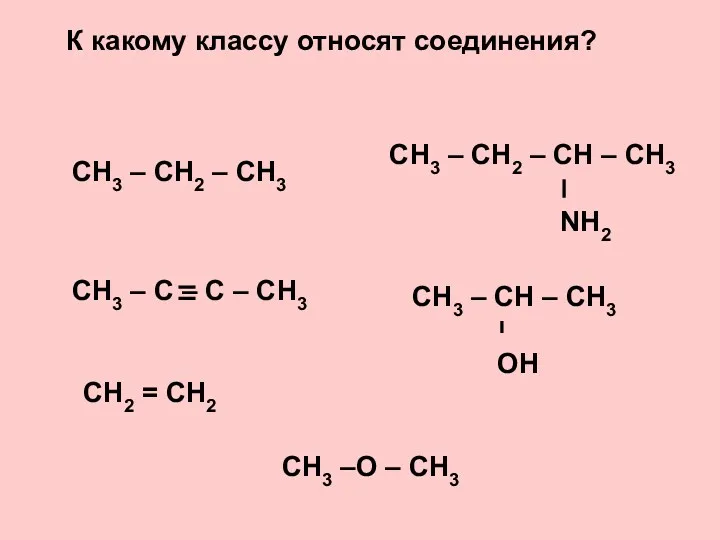 16_OP_05_Alkany
16_OP_05_Alkany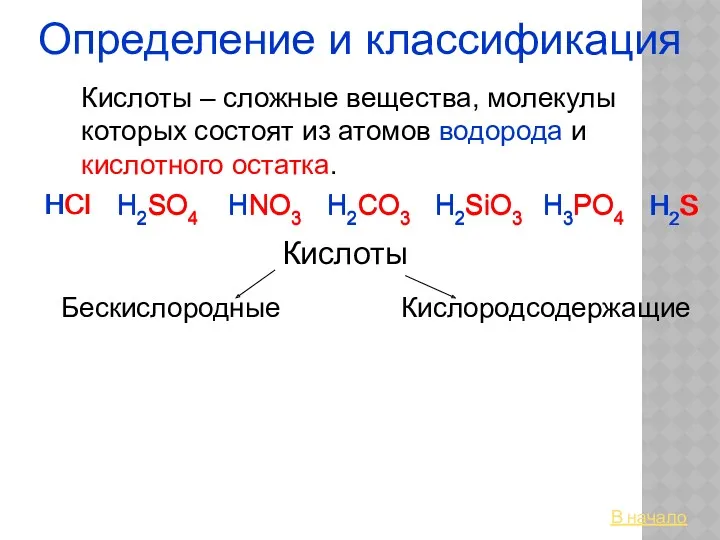 Кислоты. Определение и классификация
Кислоты. Определение и классификация Цикл трикарбоновых кислот (Ц.Кребса). Подсчёт суммарного энергетического эффекта аэробного окисления глюкозы
Цикл трикарбоновых кислот (Ц.Кребса). Подсчёт суммарного энергетического эффекта аэробного окисления глюкозы Квантово-механический подход к описанию строения атомов
Квантово-механический подход к описанию строения атомов d-элементы
d-элементы Химия и живопись
Химия и живопись Ароматические углеводороды (арены)
Ароматические углеводороды (арены)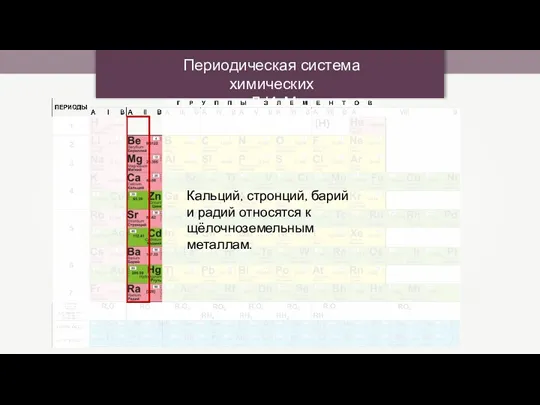 Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Химическое равновесие
Химическое равновесие Тест: полимеры
Тест: полимеры Платина. Физические и химические свойства
Платина. Физические и химические свойства Минералогия с основами кристаллографии
Минералогия с основами кристаллографии Химические реакции
Химические реакции Бордың адам ағзасына әсері
Бордың адам ағзасына әсері Гідроліз солей
Гідроліз солей Гетероциклические соединения природного и синтетического происхождения. Производные фурана и бензофурана. (Лекция 1-2)
Гетероциклические соединения природного и синтетического происхождения. Производные фурана и бензофурана. (Лекция 1-2) Соединения железа. Охарактеризуйте Fe
Соединения железа. Охарактеризуйте Fe Cross-section sample preparation using focused ion beam system (FIB) for transmission electron microscopy (TEM)
Cross-section sample preparation using focused ion beam system (FIB) for transmission electron microscopy (TEM) Вычисление массовой доли растворенного вещества. 8 класс
Вычисление массовой доли растворенного вещества. 8 класс Титриметрические методы количественного определения лекарственных веществ
Титриметрические методы количественного определения лекарственных веществ Structural, substructural properties and chemical composition
Structural, substructural properties and chemical composition Водород
Водород Композиционные материалы
Композиционные материалы Реакции ионного обмена
Реакции ионного обмена Галогенопроизводные углеводородов 1
Галогенопроизводные углеводородов 1