Содержание
- 2. Бериллий Chemicalinterest Магний Ptyx DePiep
- 4. Барий Chemicalinterest Магний Ptyx
- 5. Стронций Кальций Alchemist-hp Jurii
- 6. Кальций
- 9. Ca + CI2 = CaCI2 хлорид Химические свойства металлов главной подгруппы II группы При взаимодействии кальция
- 10. Сa + S = CaS сульфид Химические свойства металлов главной подгруппы II группы При взаимодействии кальция
- 11. 3Сa + N2 = Ca3N2 нитрид Химические свойства металлов главной подгруппы II группы При взаимодействии кальция
- 12. Сa + 2Н2О = Ca(ОН)2+ Н2 Химические свойства металлов главной подгруппы II группы Кальций (Ca), являясь
- 13. 2Сa + О2 = 2CaО Химические свойства металлов главной подгруппы II группы При нагревании на воздухе
- 14. Сa + 2С = CaС2 Химические свойства металлов главной подгруппы II группы При взаимодействии кальций с
- 15. Вследствие своей высокой химической активности в природе щёлочноземельные металлы находятся только в форме соединений. Оксиды данных
- 16. Оксид кальция
- 17. Оксид кальция CaO + H2O = Ca(OH)2 + Q
- 18. Гашёная известь
- 19. Щелочные свойства гашёной извести Ca(OH)2 + CO2 → CaCO3↓ + H2O
- 20. При пропускании через известковую воду оксида углерода (IV) раствор мутнеет. CaСO3 + CO2 + H2O Ca(HCO3)2
- 21. Карбонат кальция CaCO3
- 25. Сульфат кальция CaSO4 ⋅ 2H2О
- 26. Жжёный гипс
- 27. Если алебастр смешать с водой, то он быстро затвердевает, снова превращается в гипс. CaSO4 ⋅ 0,5H2О
- 29. Скачать презентацию

























 Иондар және олардың түзілуі
Иондар және олардың түзілуі Амины
Амины Процессы и технологическая схема производства сегодня. АО Газпромнефть-ОНПЗ
Процессы и технологическая схема производства сегодня. АО Газпромнефть-ОНПЗ Біологічна хімія з основами фізичної і колоїдної хімії
Біологічна хімія з основами фізичної і колоїдної хімії Білки та амінокислоти
Білки та амінокислоти Роль хімії у суспільстві
Роль хімії у суспільстві Общая схема радиолиза алифатических углеводородов. Радиолиз органических кислот. Радиолиз кетонов эфиров
Общая схема радиолиза алифатических углеводородов. Радиолиз органических кислот. Радиолиз кетонов эфиров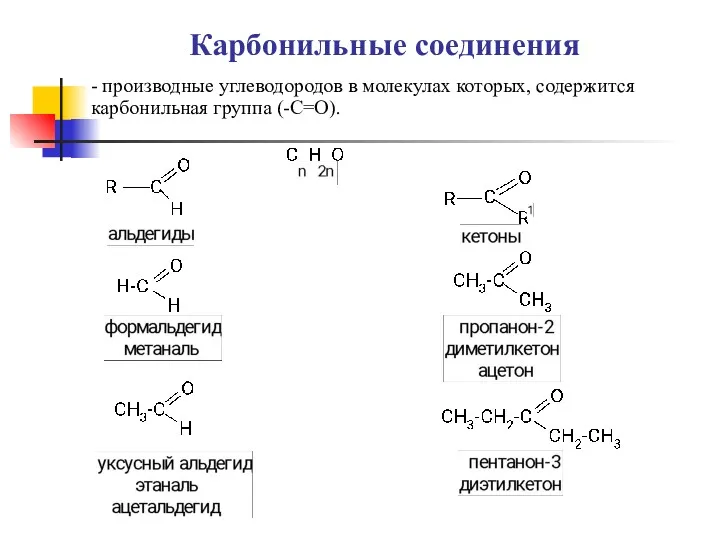 Карбоновые кислоты, альдегиды
Карбоновые кислоты, альдегиды Оксиды. Номенклатура, классификация, физические свойства
Оксиды. Номенклатура, классификация, физические свойства Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1
Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1 Формирование ключевых и предметных компетенций учащихся при изучении темы “Металлы”
Формирование ключевых и предметных компетенций учащихся при изучении темы “Металлы” Метаболизм нуклеотидов
Метаболизм нуклеотидов Серная кислота и её свойства. 9 класс
Серная кислота и её свойства. 9 класс Галогены. Химические свойства. Применение
Галогены. Химические свойства. Применение Пластмасса, пластикалық материалдар
Пластмасса, пластикалық материалдар Електролітична дисоціація. Електроліти та неелектроліти. Урок хімії в 9 класі
Електролітична дисоціація. Електроліти та неелектроліти. Урок хімії в 9 класі Сахар - вред или польза?
Сахар - вред или польза? Lesson 2 and 3. The chemistry of life
Lesson 2 and 3. The chemistry of life Жири як представники естерів. Класифікація жирів, їхні хімічні властивості
Жири як представники естерів. Класифікація жирів, їхні хімічні властивості Соли как производные кислот и оснований
Соли как производные кислот и оснований Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Фазовые диаграммы
Фазовые диаграммы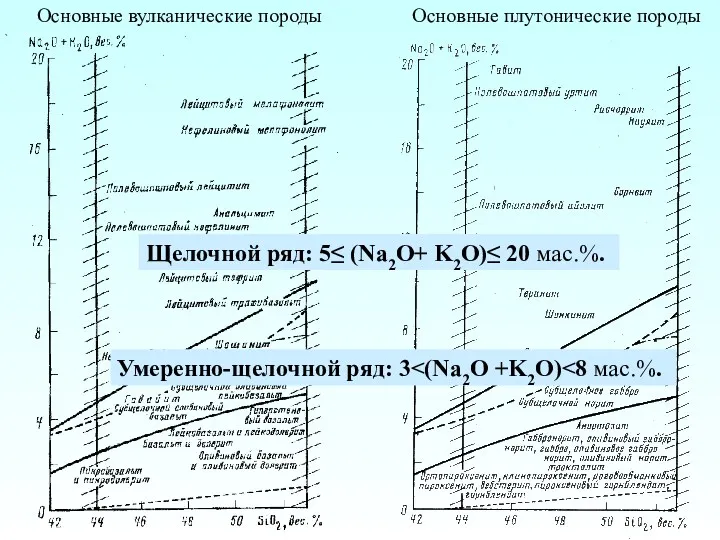 Основные вулканические породы. Основные плутонические породы
Основные вулканические породы. Основные плутонические породы λ-MnO2 as material with pseudocapacitive properties
λ-MnO2 as material with pseudocapacitive properties Электролиз Урок для 11 класса
Электролиз Урок для 11 класса Теории происхождения нефти
Теории происхождения нефти Полибутадиен
Полибутадиен Алкандар. Метан және оның құрылысы
Алкандар. Метан және оның құрылысы