Содержание
- 2. Мета: Дати відповідь на запитання: Чому одні речовини проводять струм, а інші - ні? Як їх
- 3. Цілі: Електролітична дисоціація. Електроліти та неелектроліти. ТЕД(теорія електролітичної дисоціації) Електролітична дисоціація кислот, основ, солей у водних
- 4. Як ви думаєте: які з цих речовин будуть проводити електричний струм?
- 5. Чи всі речовини проводять струм?
- 6. Н2О Не проводить електричний струм
- 7. NaCl Не проводить електричний струм
- 8. Що являє собою кристал натрій хлориду? У кристалі солі йони утримуються за рахунок сил електростатичного притягання.
- 9. NaCl Розчин проводить електричний струм
- 10. Що відбувається з кристалом натрій хлориду, коли він потрапляє у воду? Між йонами кристалічних граток і
- 11. NaОH Розчин проводить електричний струм розчин
- 12. В розчині існують гідратовані йони Натрію та гідроксид йони
- 13. НCl Розчин проводить електричний струм
- 14. 2. Гідратація - (взаємодія) молекул води з молекулами електроліта + ─ Н+ Cl─ + ─ +
- 15. 3. йонізація молекул електроліта (перетворення ковалентного зв'язку на йони ) 4. дисоціація (розпад) молекул електроліта на
- 16. Поляризовані молекули води орієнтуються навкруги полюсів молекули хлороводню та взаємодіють з нею Спільна електронна пара переходить
- 17. К а т о д Н+ Cl─ А н о д Н+ Cl─ Cl─ Н+ Н+
- 18. С12Н12О11 розчин Не проводить електричний струм
- 19. Цукор в розчині розпадається до молекул
- 20. Таблиця результатів спостереження Н2О неелектроліт неелектроліт електроліт електроліт електроліт NaCl С12Н12О11 NaОH НCl
- 21. Майкл Фарадей запропонував поділити речовини на дві групи за здатністю проводити струм
- 22. Натисніть Натисніть Клас сполук Клас сполук Тип зв’язку Тип зв’язку
- 23. Чому електроліти проводять струм? При розчиненні речовини чи при сплавленні з’являються зарядженні частинки, які можуть вільно
- 24. Йони - заряджені частинки Катіони – позитивно заряджені йони Аніони – негативно заряджені йони
- 25. Теорію електролітичної дисоціації сформулював швед Сванте Арреніус (1887 р.), за що у 1901 р. отримав Нобелівську
- 26. Сучасний зміст ТЕД можна звести до чотирьох основних положень I- положення: Всі речовини по їх здатності
- 27. ІІ положення: В розчинах електроліти дисоціюють (розпадаються) на позитивні (катіони)і негативні (аніони) йони. ІІІ положення: Причиною
- 29. Речовини, розчини яких проводять електричний струм. Процес розпаду електроліту на йони. Позитивно заряджені йони. Негативно заряджені
- 30. Підкресліть речовини – електроліти хлоридна кислота, кисень, натрій хлорид, натрій гідроксид, спирт, ацетон, кальцій гідроксид, глюкоза,
- 31. завдання 1 Назвіть катіони: Sn2+, OH−, Al3+, PO43−, K+, Fe2+, Cl− SiO32−, Ва2+, К+, Fe3+, SO42-?
- 33. Скачать презентацию






























 Месторождения берилла и топаза
Месторождения берилла и топаза Химический эквивалент. Формульные единицы
Химический эквивалент. Формульные единицы Metode electrochimice. Generalităţi
Metode electrochimice. Generalităţi Соединения железа
Соединения железа Соединения кальция. Жесткость воды и способы её устранения
Соединения кальция. Жесткость воды и способы её устранения Электролитическая диссоциация. 9 класс
Электролитическая диссоциация. 9 класс Методика преподавания химии
Методика преподавания химии Высшие жирные кислоты. Липиды
Высшие жирные кислоты. Липиды Электронные конфигурации атомов
Электронные конфигурации атомов Метод молекулярных орбиталей
Метод молекулярных орбиталей Натуральные, искуственные и синтетические материалы
Натуральные, искуственные и синтетические материалы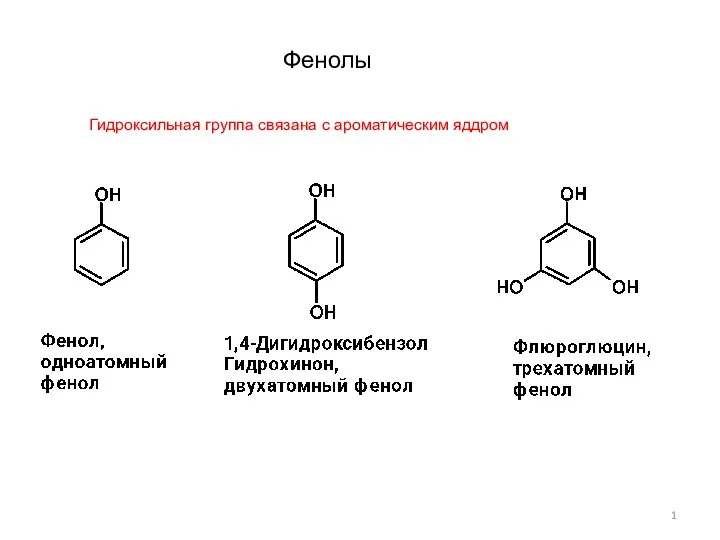 Фенолы-1
Фенолы-1 Группа веществ, изолируемых из биологического материала дистилляцией
Группа веществ, изолируемых из биологического материала дистилляцией Введение. Предмет и содержание фармацевтической химии, её связи с другими науками
Введение. Предмет и содержание фармацевтической химии, её связи с другими науками Естери. Класифікація та номенклатура естерів
Естери. Класифікація та номенклатура естерів Электронное строение элементов главной подгруппы III группы
Электронное строение элементов главной подгруппы III группы Сложные эфиры
Сложные эфиры Основні класи неорганічних сполук
Основні класи неорганічних сполук Насичені одноатомні спирти, їх фізичні та хімічні властивості. Одержання етанолу
Насичені одноатомні спирти, їх фізичні та хімічні властивості. Одержання етанолу Производство полимеров
Производство полимеров Элементтер-органогендер. өмір металдары. Көміртек – органикалық қосылыстардың негізін құраушы
Элементтер-органогендер. өмір металдары. Көміртек – органикалық қосылыстардың негізін құраушы Гетероциклические соединения
Гетероциклические соединения Свойства воды. Оценка качества
Свойства воды. Оценка качества Відносна молекулярна маса речовини, її обчислення за хімічною формулою
Відносна молекулярна маса речовини, її обчислення за хімічною формулою ОВР – окислительно-восстановительные реакции. Тема 4
ОВР – окислительно-восстановительные реакции. Тема 4 Solutions and solubilities
Solutions and solubilities Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Генетическая связь между основными классами неорганических веществ
Генетическая связь между основными классами неорганических веществ