Содержание
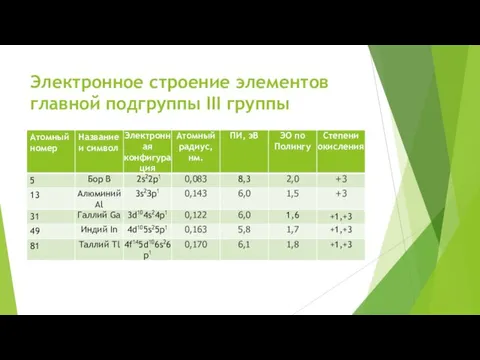
- 2. Электронное строение элементов главной подгруппы III группы
- 3. Al — Алюминий Алюминий — основной представитель металлов главной подгруппы III группы Периодической системы. Свойства его
- 4. Al — Алюминий Алюминий – химически активный металл, но прочная оксидная пленка определяет его стойкость при
- 5. Химические свойства Al Взаимодействие с водой Взаимодействие с кислотами Взаимодействие с галогенами Взаимодействие с O2 Взаимодействие
- 6. Распространенность По распространённости в земной коре Земли занимает 1-е место среди металлов и 3-е место среди
- 8. Скачать презентацию




 Натуральный каучук
Натуральный каучук Физические и химические явления. Признаки и условия протекания химических реакций
Физические и химические явления. Признаки и условия протекания химических реакций Теория электролитической диссоциации
Теория электролитической диссоциации Низкомолекулярные компоненты сыворотки крови
Низкомолекулярные компоненты сыворотки крови Целевой и содержательный компоненты процесса обучения химии
Целевой и содержательный компоненты процесса обучения химии Углеводы. Моносахариды
Углеводы. Моносахариды Неметаллы
Неметаллы Икаит Ca[CO3]·6 (H2O)
Икаит Ca[CO3]·6 (H2O) История открытия периодической системы химических элементов Д.И. Менделеева
История открытия периодической системы химических элементов Д.И. Менделеева Платиновые металлы
Платиновые металлы Количественный учет влияния заместителя на реакционную способность и его использование для интерпретации механизмов реакций
Количественный учет влияния заместителя на реакционную способность и его использование для интерпретации механизмов реакций Окислы и их свойства
Окислы и их свойства Аммиак. Образование молекулы аммиака
Аммиак. Образование молекулы аммиака Каталитический риформинг
Каталитический риформинг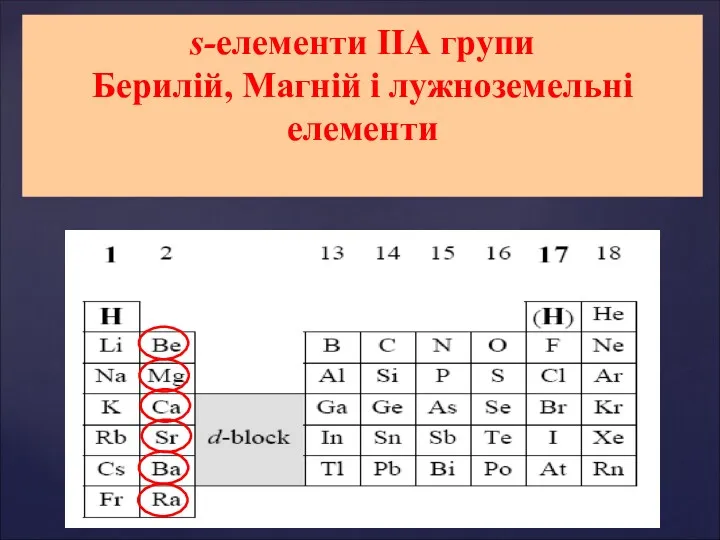 s-елементи ІІ А групи: Берилій, Магній і лужноземельні елементи. Властивості елементів ІІ А групи
s-елементи ІІ А групи: Берилій, Магній і лужноземельні елементи. Властивості елементів ІІ А групи Физические и химические свойства аренов
Физические и химические свойства аренов Дисперсные системы
Дисперсные системы Растворение. Растворимость веществ в воде
Растворение. Растворимость веществ в воде Анализ качества лекарственных веществ, определяемых методом комплексонометрии
Анализ качества лекарственных веществ, определяемых методом комплексонометрии Классификация моторных масел
Классификация моторных масел Водород. Общая характеристика, получение, свойства
Водород. Общая характеристика, получение, свойства Вугдеводи. Моносахариди
Вугдеводи. Моносахариди Литология. Кремнистые породы
Литология. Кремнистые породы Природный и искусственный камень
Природный и искусственный камень Щелочные металлы
Щелочные металлы Химия в повседневной жизни человека
Химия в повседневной жизни человека Метрологические основы аналитической химии
Метрологические основы аналитической химии Молекулярные и немолекулярные вещества
Молекулярные и немолекулярные вещества