Содержание
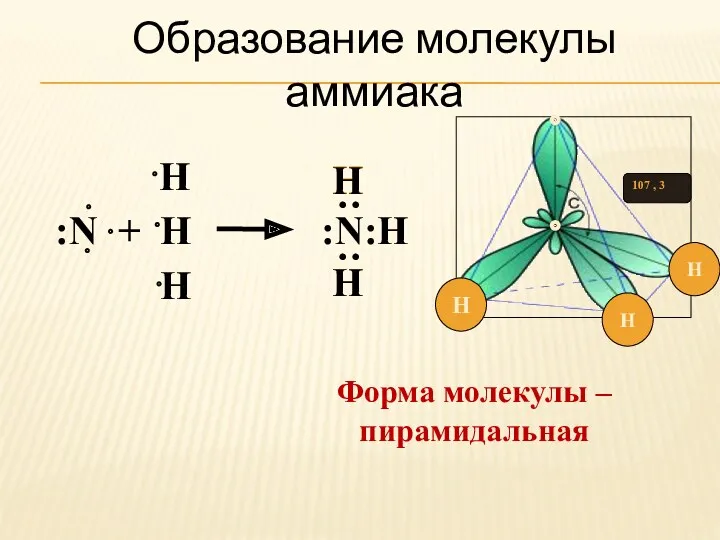
- 2. Образование молекулы аммиака :N + H :N:Н Н Н Н : : Н ⋅ ⋅ ⋅
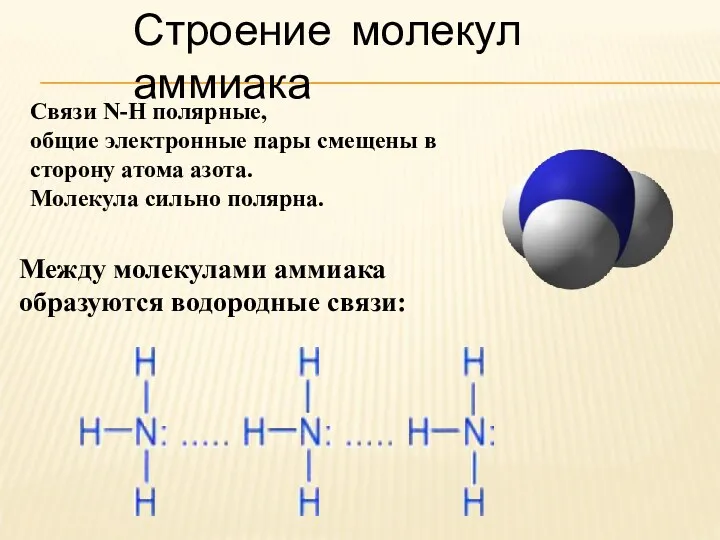
- 3. Строение молекул аммиака Между молекулами аммиака образуются водородные связи: Связи N-H полярные, общие электронные пары смещены
- 4. Физические свойства аммиака Бесцветный газ с резким запахом. Почти в два раза легче воздуха: При охлаждении
- 5. Способы получения аммиака В промышленности: N2 + 3H2 2NH3 Усл: Кат., Р, t В лаборатории: Действием
- 6. Химические свойства аммиака NH3 – низшая степень окисления азота. -3 I. Аммиак - восстановитель Реакция горения
- 7. II. Основные свойства аммиака: При растворении аммиака в воде образуется гидрат аммиака, который диссоциирует: NH3 +
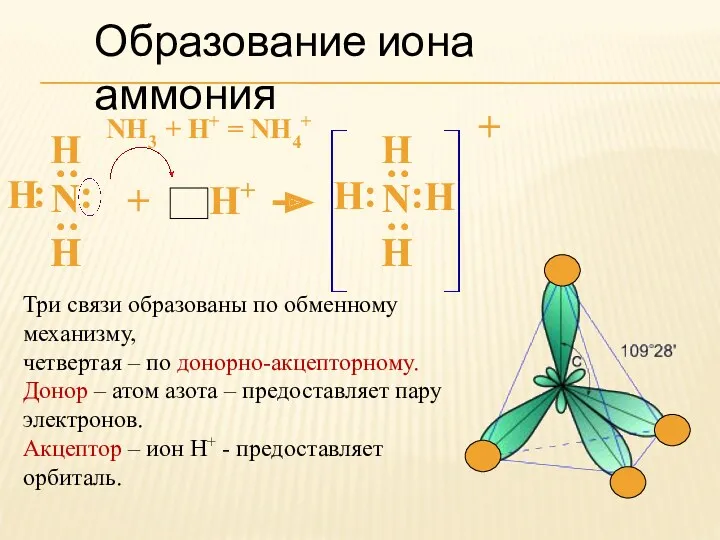
- 8. Образование иона аммония NH3 + H+ = NH4+ Н : : Н Н : : Н
- 9. Соли аммония Ион аммония по размерам и заряду близок к ионам щелочных металлов, поэтому соли аммония
- 10. Разложение солей аммония при нагревании 1. Соли летучих кислот: NH4Cl = NH3 + HCl (NH4)2CO3 =
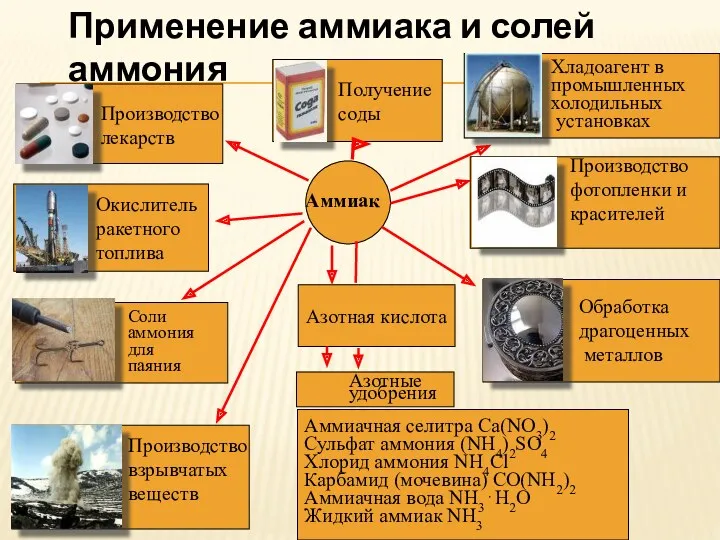
- 11. Азотная кислота Аммиачная селитра Ca(NO3)2 Сульфат аммония (NH4)2SO4 Хлорид аммония NH4Cl Карбамид (мочевина) CO(NH2)2 Аммиачная вода
- 13. Скачать презентацию






 Соединения химических элементов. Урок-игра. 8 класс
Соединения химических элементов. Урок-игра. 8 класс Комплексонометрия – метод количественного титриметрического анализа
Комплексонометрия – метод количественного титриметрического анализа Экстракционные методы выделения продуктов микробиологического синтеза
Экстракционные методы выделения продуктов микробиологического синтеза Химическая связь
Химическая связь Общая характеристика и источники сырья производств основного органического и нефтехимического синтеза. Лекция № 5-6
Общая характеристика и источники сырья производств основного органического и нефтехимического синтеза. Лекция № 5-6 большая стирка
большая стирка Алкадиены. Гомологический ряд, номенклатура и изомерия
Алкадиены. Гомологический ряд, номенклатура и изомерия Химическая связь
Химическая связь Бор шикізатын қышқылдық ыдырату
Бор шикізатын қышқылдық ыдырату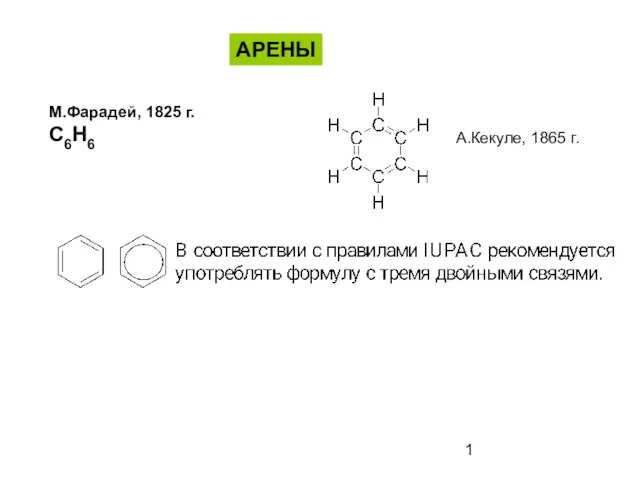 Ароматические соединения - арены
Ароматические соединения - арены Водородная связь
Водородная связь Электролиты и неэлектролиты. Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей
Электролиты и неэлектролиты. Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей Атомный и ионный радиусы. Принципы шаровых упаковок
Атомный и ионный радиусы. Принципы шаровых упаковок Азот и его соединения
Азот и его соединения Технология оптического стекла
Технология оптического стекла Современная химия. (Лекция 6)
Современная химия. (Лекция 6) Электрохимические процессы
Электрохимические процессы Простые вещества
Простые вещества Кислород
Кислород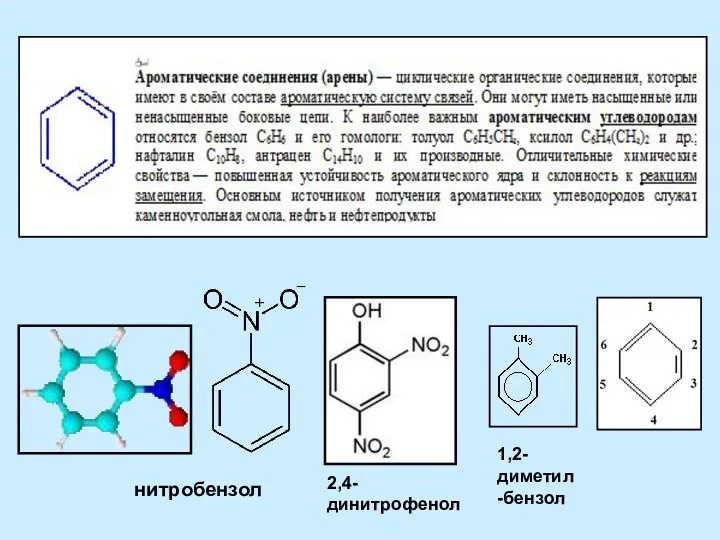 Ароматические соединения (арены)
Ароматические соединения (арены) Алкалоидтар
Алкалоидтар Лекция 2. Строение атома и Периодический закон Д.И. Менделеева
Лекция 2. Строение атома и Периодический закон Д.И. Менделеева Тепловой эффект химических реакций. 8 класс
Тепловой эффект химических реакций. 8 класс Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Общая характеристика твердого, жидкого и газообразного видов топлива
Общая характеристика твердого, жидкого и газообразного видов топлива Химия в строительстве
Химия в строительстве Кислотные и основные свойства органических соединений
Кислотные и основные свойства органических соединений Углерод
Углерод