Содержание
- 2. Химическая связь Химическая связь - это понижение энергии атомов при образовании молекулы.
- 3. Параметры химической связи: Энергия Длина Валентный угол Кратность Полярность
- 4. Длина связи Длина связи – это расстояние между связанными атомами или между их ядрами.
- 5. Валентный угол Валентный угол – это угол между воображаемыми линиями соединяющими центры атомов. Н2 ∠ (H-H)
- 6. Энергия связи: Энергией химической связи называется энергия которая выделяется при образовании связи или которая затрачивается на
- 7. 1А0 = 10-10м Зависимость энергии связи от длины:
- 8. Химическая связь Химической связью называется взаимодействие двух или нескольких атомов, которое приводит к образованию химически устойчивой
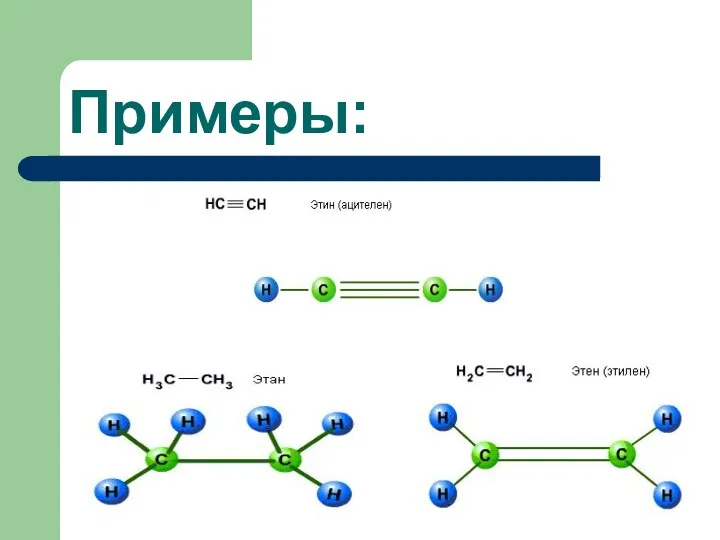
- 9. Кратность связи Кратность связи – это количество связей образующихся между атомами.
- 10. Примеры:
- 11. Теории химической связи
- 12. Теории химической связи Льюис - теория ковалентной связи - химическая связь образуется за счёт общей электронной
- 13. Реальный заряд на атоме в соединении называют эффективным зарядом атома δ.
- 14. Чисто ионная связь практически никогда не образуется. Но во всех случаях при образовании химической связи происходит
- 15. Полярность химической связи
- 16. Полярность химической связи
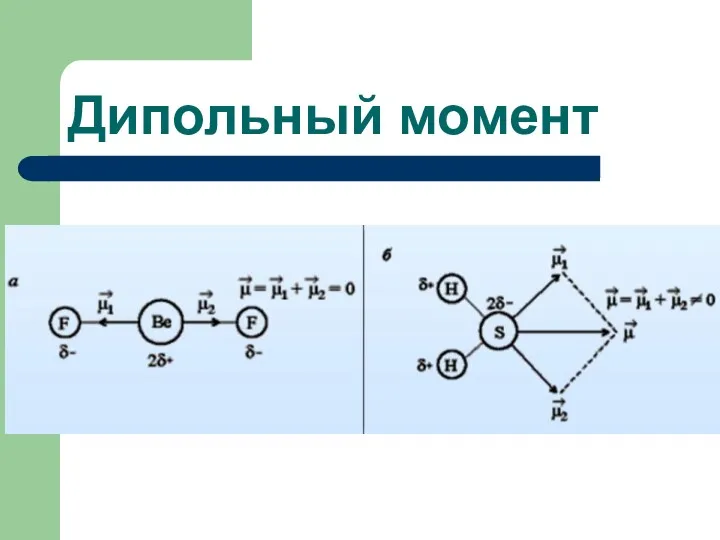
- 17. Полярность химической связи Если электроотрицательность атомов образующих связь различна, то молекула является полярной и образует диполь,
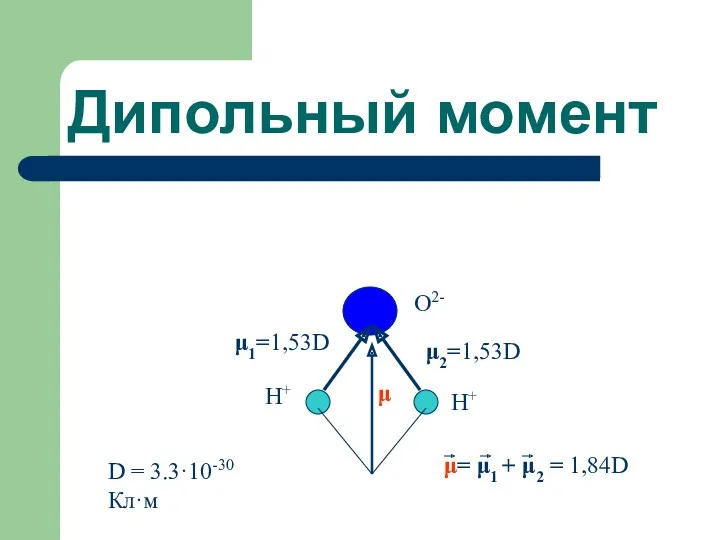
- 18. Дипольный момент Дипольный момент – это векторная величина. Вектор дипольного момента направлен от положительного заряда к
- 19. Дипольный момент Н+ Н+ О2- μ1=1,53D μ2=1,53D μ= μ1 + μ2 = 1,84D μ D =
- 20. Дипольный момент
- 21. Типы химических связей Ковалентная а) неполярная б) полярная Ионная Металлическая Межмолекулярные связи: а) водородная б) силы
- 22. Ковалентная связь Ковалентная неполярная – это связь образующаяся между атомами с одинаковой электроотрицательностью. Н – Н
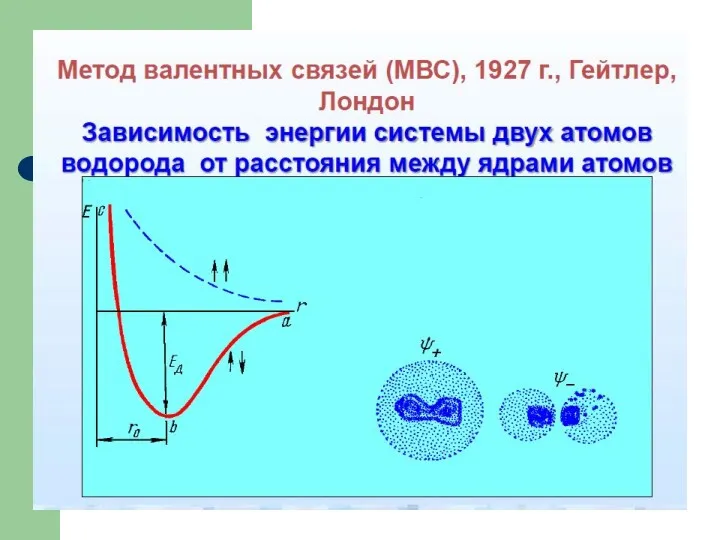
- 23. Ковалентная теория Два основных подхода ковалентной теории, два квантово-механических метода: метод валентных связей (МВС) и метод
- 24. Метод валентных связей (МВС)
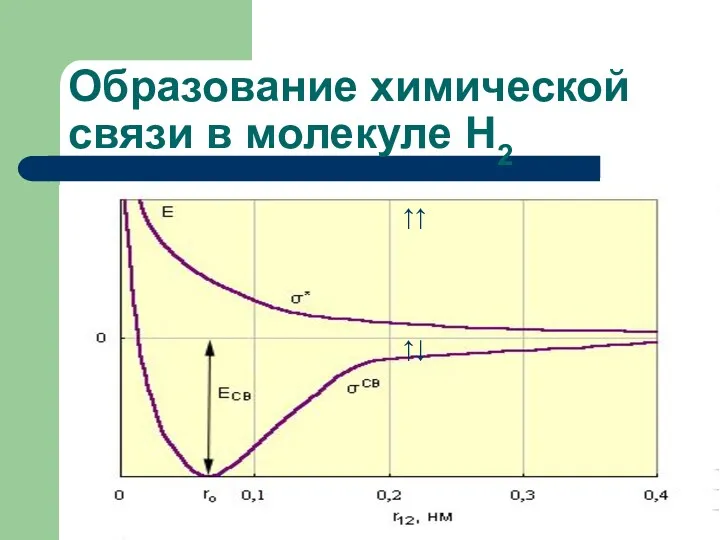
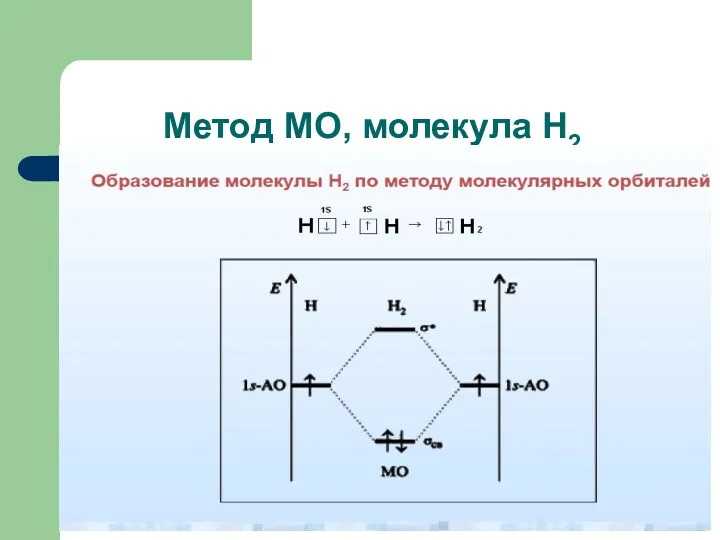
- 25. Образование химической связи в молекуле Н2 ↑↑ ↑↓
- 27. Образование ковалентной связи Образование химической связи согласно МВС происходит при условии: спины электронов сближающихся атомов антипараллельны
- 28. Это Первый принцип МВС: принцип локализованных электронных пар
- 29. Второй принцип МВС : Принцип максимального перекрывания атомных орбиталей. (связь образуется той орбиталью атома, которая максимально
- 31. Свойства ковалентной связи Насыщаемость – показывает, что атом образует не любое, а ограниченное количество связей. Их
- 32. Свойства ковалентной связи
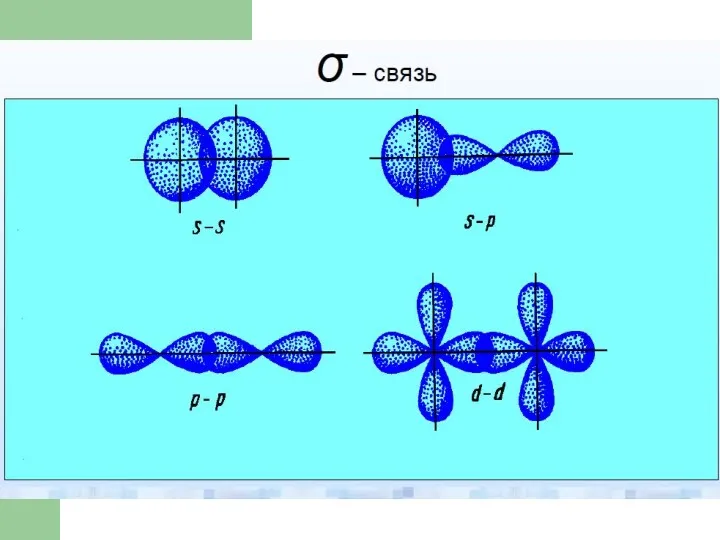
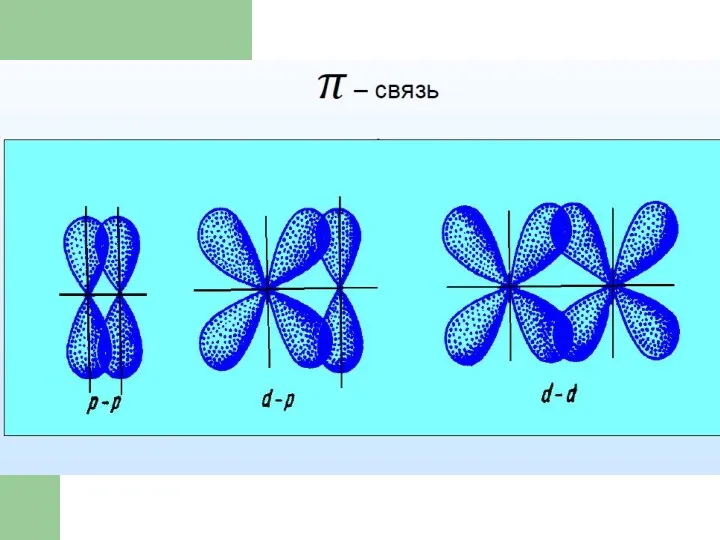
- 33. Свойства ковалентной связи Направленность – в зависимости от перекрывания и симметрии образованные орбитали различают на сигма,
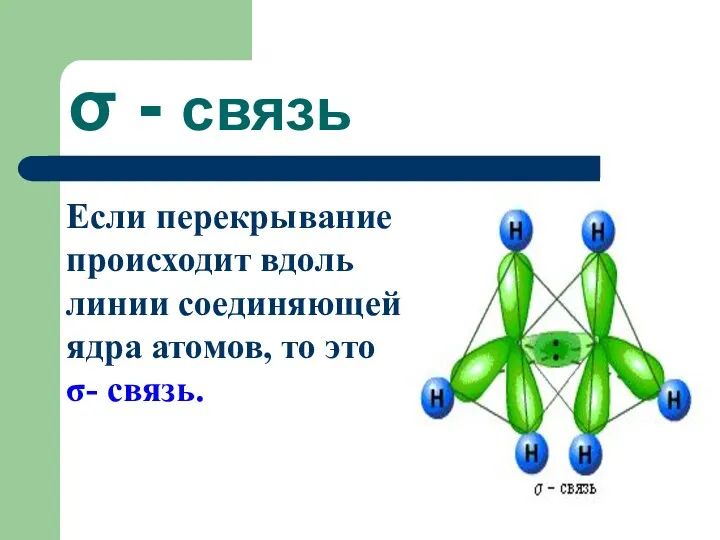
- 36. σ - связь Если перекрывание происходит вдоль линии соединяющей ядра атомов, то это σ- связь.
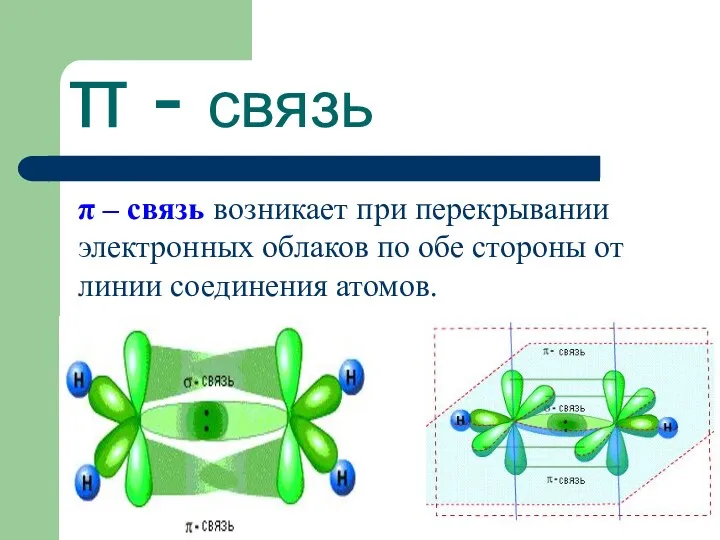
- 38. π - связь π – связь возникает при перекрывании электронных облаков по обе стороны от линии
- 39. δ - связь δ - связь образуется за счет перекрывания всех четырех лопастей d – электронных
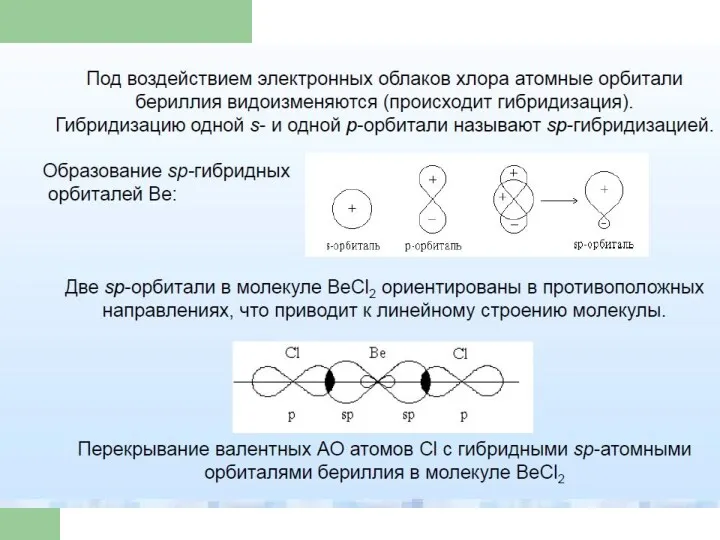
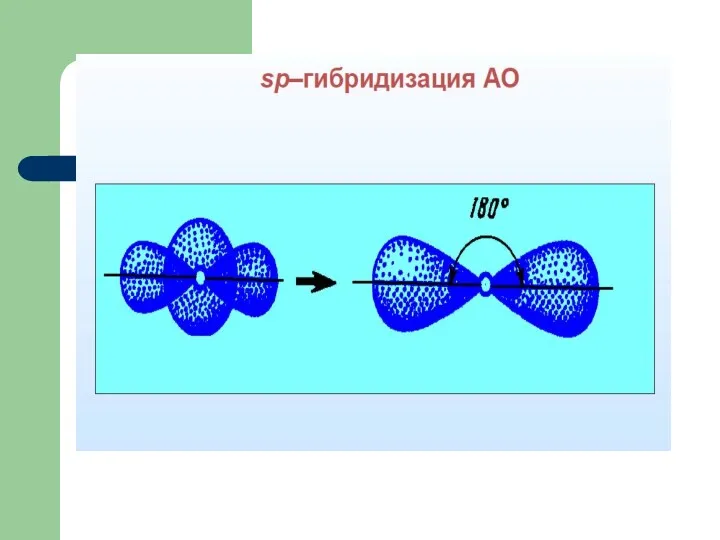
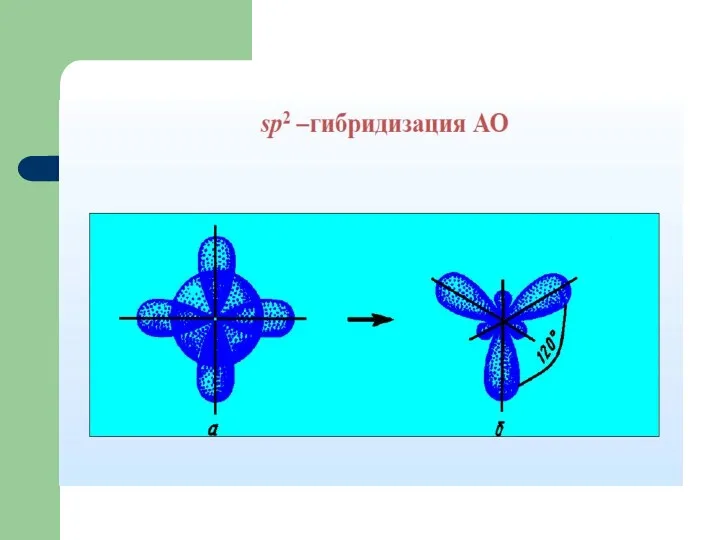
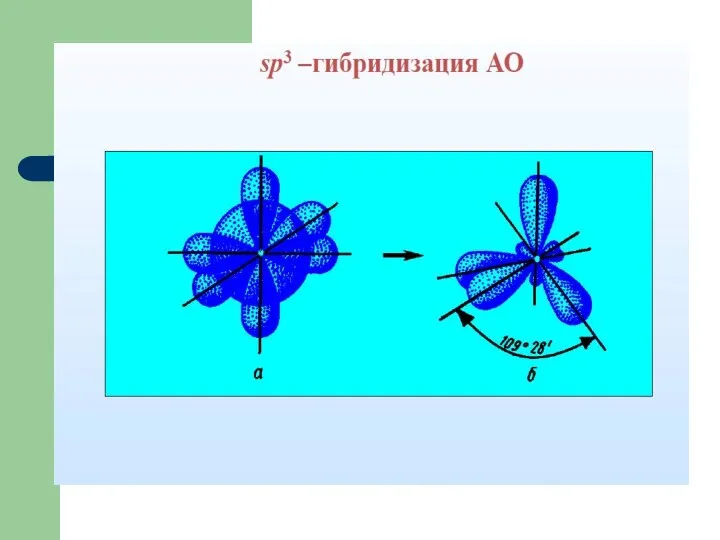
- 41. Гибридизация атомных орбиталей Гибридизация – это изменение первоначальной формы атомных орбиталей приводящее к образованию гибридных орбиталей
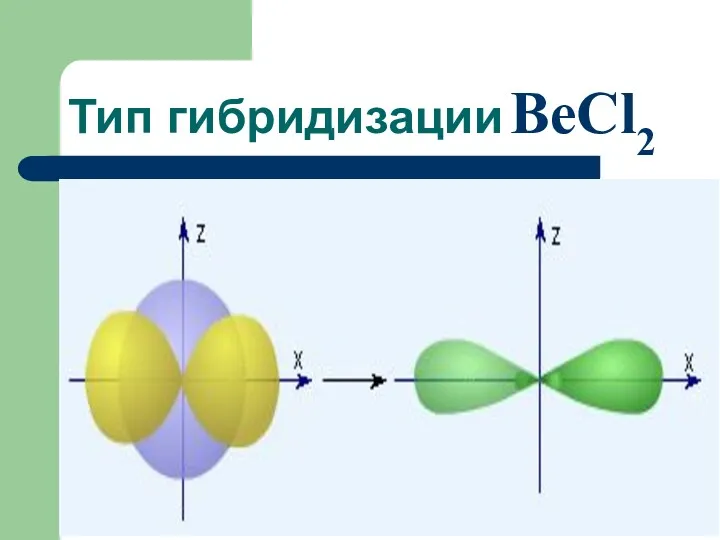
- 45. Тип гибридизации BeCl2
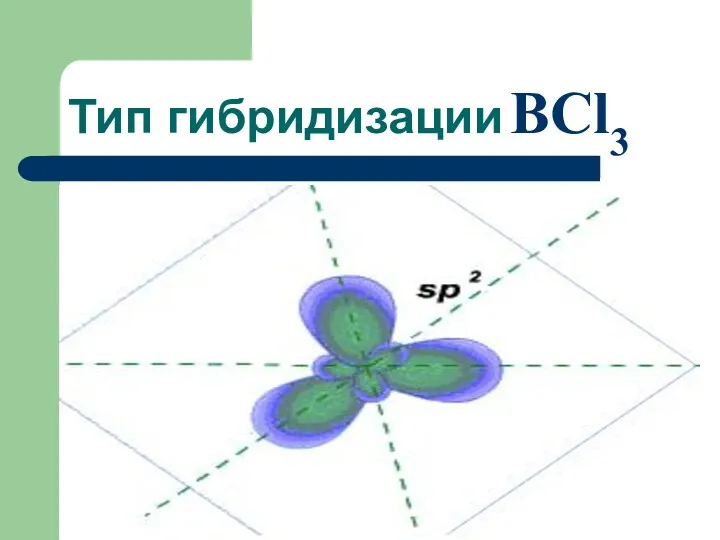
- 47. Тип гибридизации BCl3
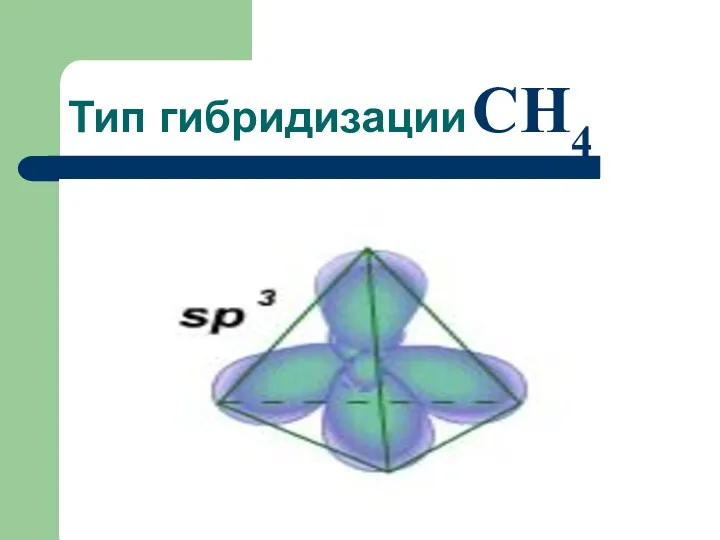
- 49. Тип гибридизации CH4
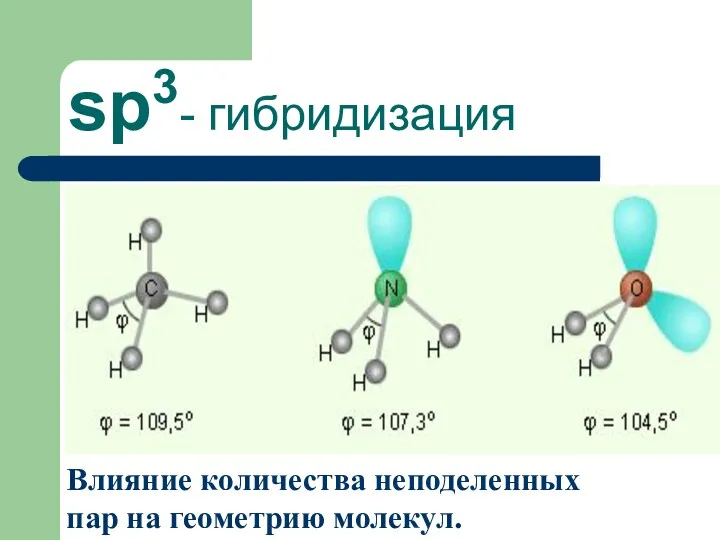
- 50. sp3- гибридизация Влияние количества неподеленных пар на геометрию молекул.
- 51. Конфигурация молекул с ковалентными связями
- 52. Геометрические структуры сложных молекул по Гиллеспи
- 53. Как определить тип гибридизации? Нужно рассмотреть АО центрального атома в молекуле. В гибридизации участвуют АО, образующие
- 54. Достоинства МВС 1. МВС позволяет определить максимальную ковалентность. (максимальное число валентных атомных орбиталей, способных участвовать в
- 55. Недостатки МВС 1. МВС считает все связи локализованными, двухцентровыми. 2. МВС не может дать объяснение упрочнению
- 56. Поляризация и поляризуемость химической связи Смещение электронов, осуществляющих химическую связь, в сторону более электроотрицательного атома, называется
- 58. Метод молекулярных орбиталей (ММО) В основе ММО лежит представление о химической связи как движении всех электронов
- 59. Основные положения ММО
- 60. Основные положения ММО МО - делокализованные и многоцентровые. АО должны быть близкими по энергии, перекрываться в
- 61. Основные положения ММО Связывающая МО – МО, энергия которой ниже энергии исходных АО. Разрыхляющая МО -
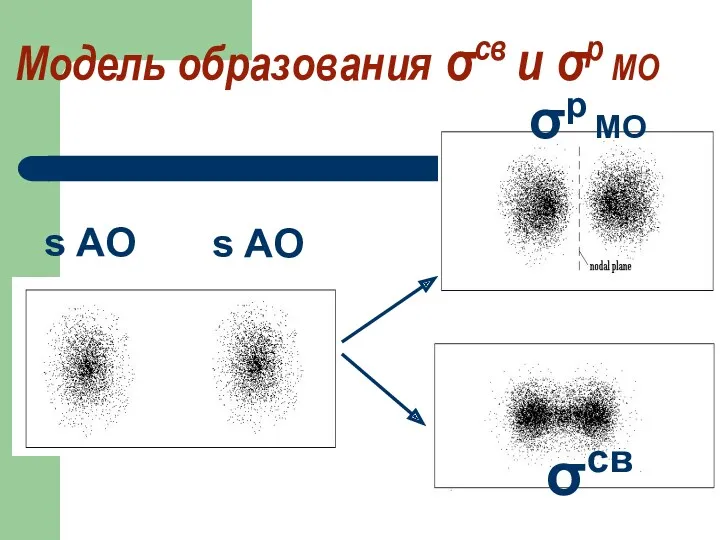
- 62. Модель образования σсв и σр МО σр МО σсв s AO s AO
- 63. Метод МО, молекула Н2
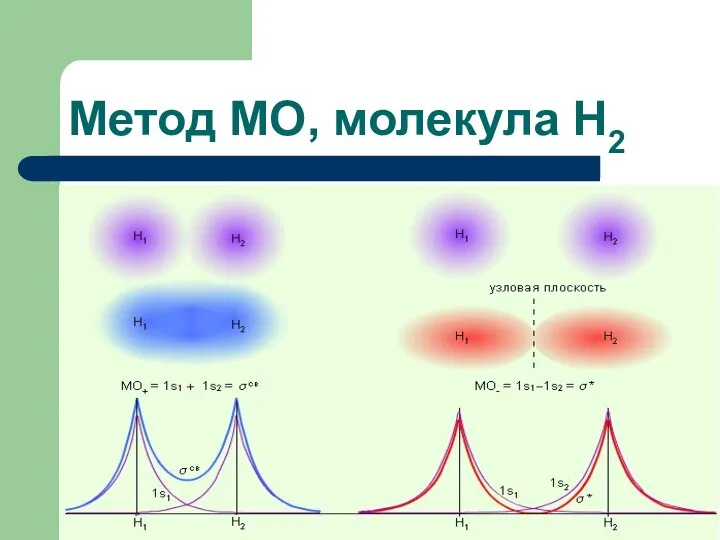
- 64. Метод МО, молекула Н2
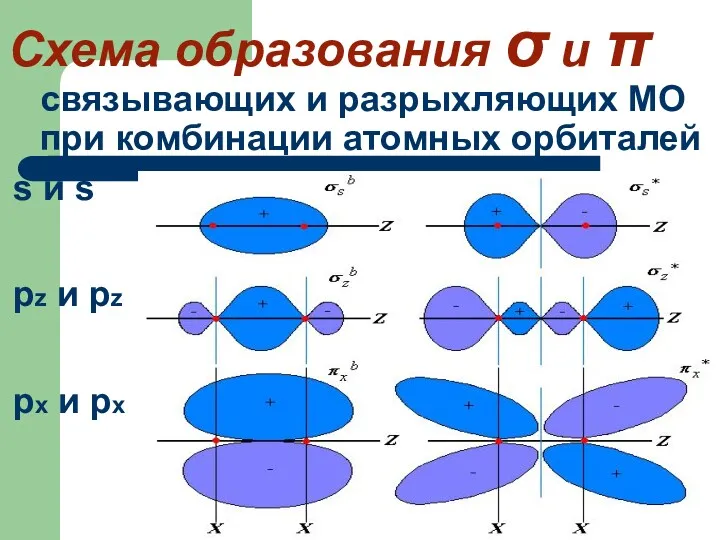
- 65. Схема образования σ и π связывающих и разрыхляющих МО при комбинации атомных орбиталей s и s
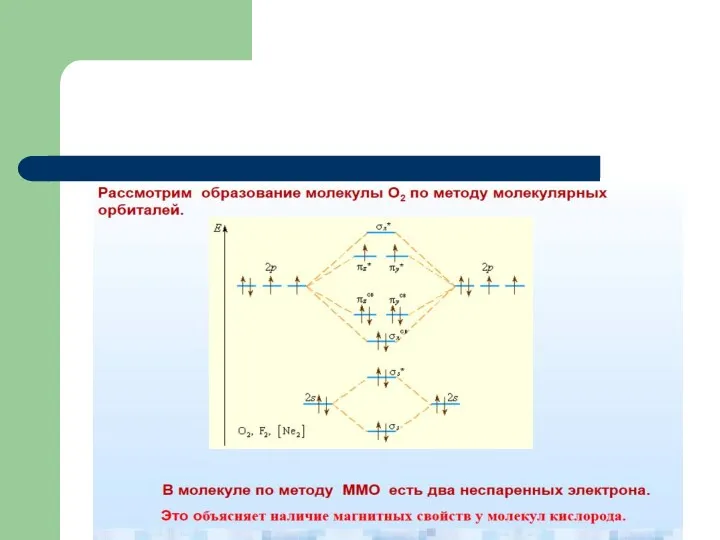
- 67. Двухатомные гомоядерные молекулы элементов второго периода валентные орбитали атомов одинаковы: 2s -, 2px - , 2py
- 68. 2pz АО при сложении образуют πzсвяз. – и πzразр. – МО. Аналогично 2py – АО образуют
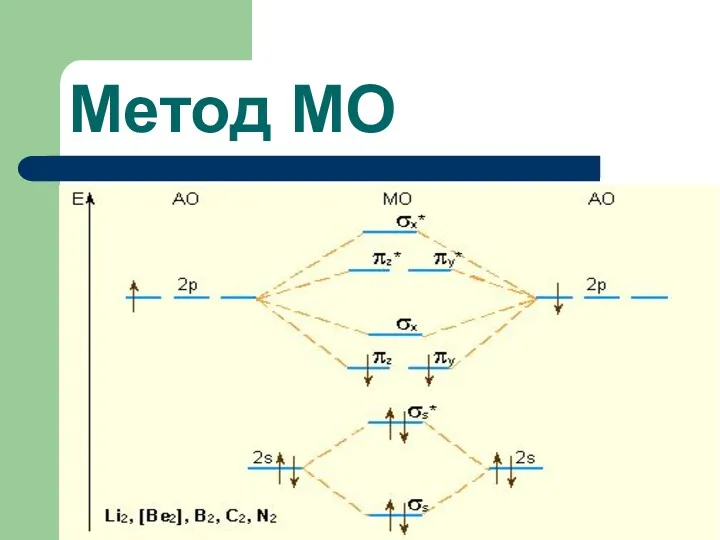
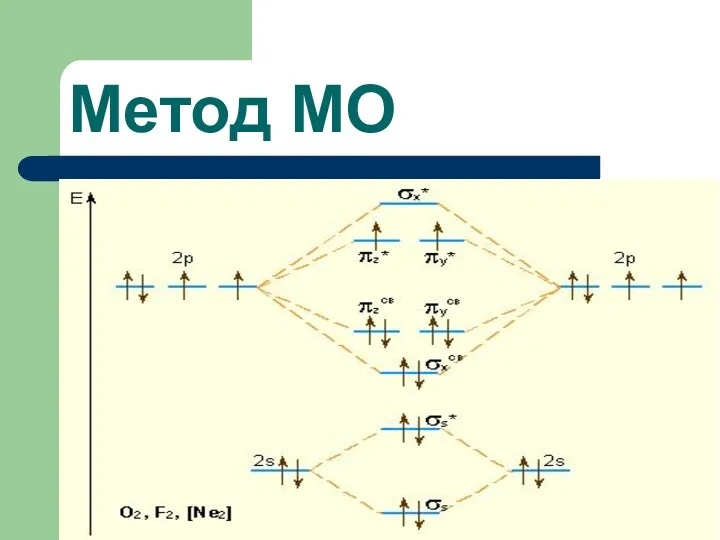
- 69. Метод МО
- 70. Метод МО
- 71. ММО объясняет изменение прочности связи при ионизации молекул. Удаление связывающего электрона (например, из В2, С2, N2)
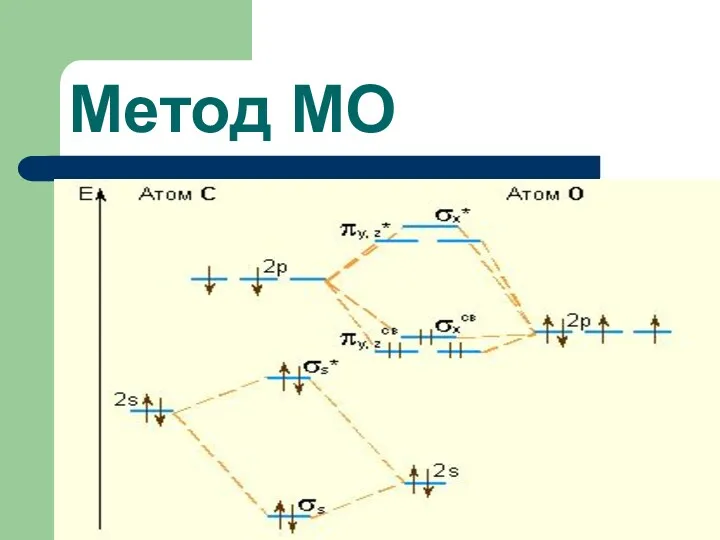
- 72. Двухатомные гетероядерные молекулы в связывающую МО больший вклад вносят АО более ЭО-го атома, а в разрыхляющую
- 73. Метод МО
- 74. Трёхатомные линейные молекулы Энергетическая диаграмма молекулы ВеН2 Орбитали более отрицательных атомов водорода (1s) лежат ниже АО
- 75. Достоинства ММО ММО позволяет: 1) рассчитать распределение электронной плотности в молекуле; 2) определить энергию связи; 3)
- 76. Общее в МВС и ММО Химическая связь - обобщение электронов. Для образования связи необходимо перекрывание орбиталей.
- 77. Различие МВС и ММО 1) ММО основывается на делокализации не только π - , но и
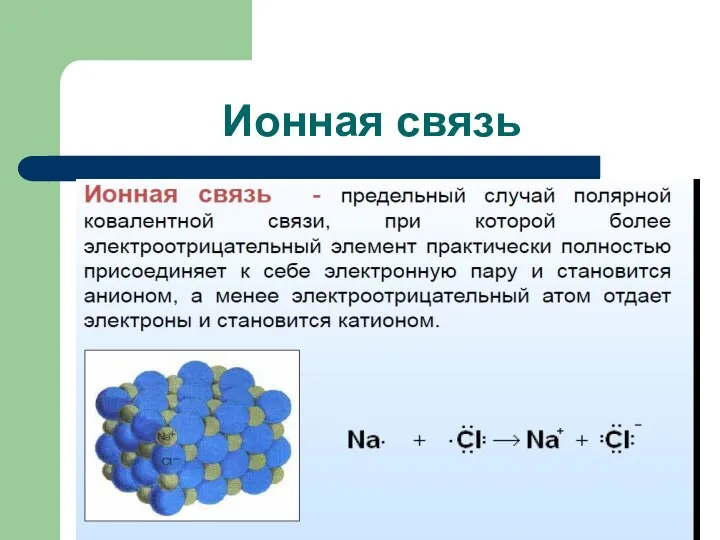
- 78. Ионная связь
- 79. Ионная связь Энергия связи определяется силами электростатического взаимодействия противоположно заряженных ионов Ионные соединения состоят из огромного
- 80. Ненасыщаемость и ненаправленность Правило Магнуса – Гольдшмидта: координационное число для данного иона (шара) определяется тем, сколько
- 81. Ненасыщаемость и ненаправленность Ион притягивает независимо от направления неограниченное число противоположно заряженных ионов из-за сил электростатического
- 82. Ионная связь Ионные соединения при обычных условиях – твердые и прочные, но хрупкие вещества При плавлении
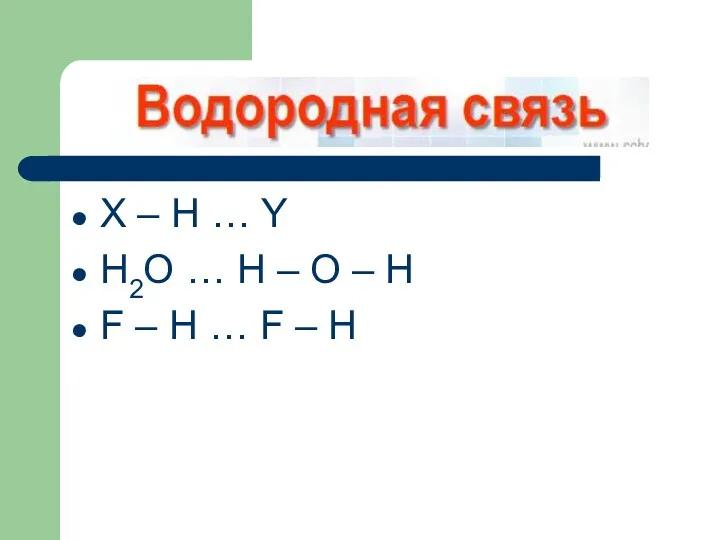
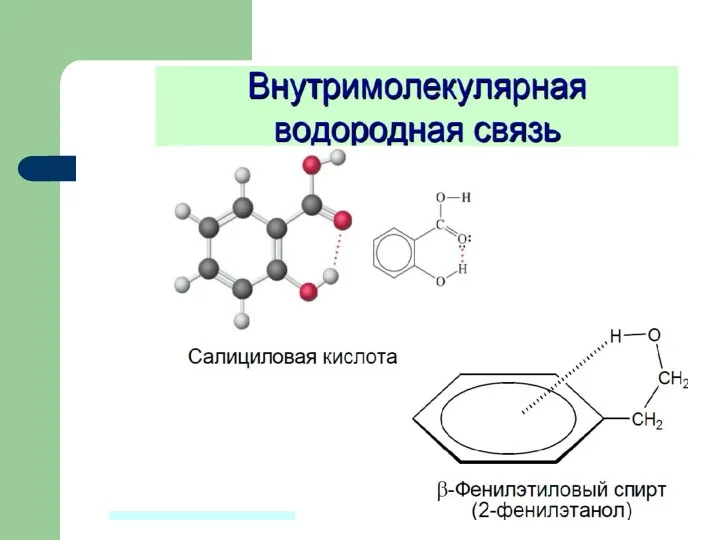
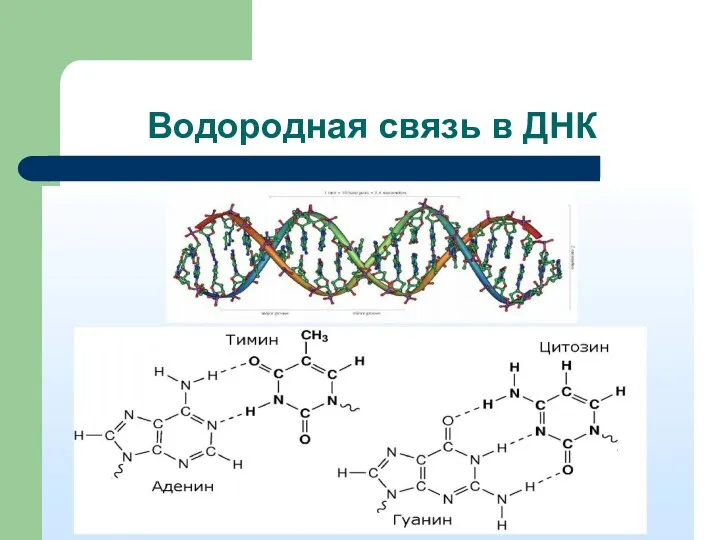
- 83. Водородная связь это связь между сильно электроотрицательными атомами посредством атома водорода. Водородная связь осуществляется только между
- 84. X – H … Y H2O … H – O – H F – Н …
- 87. Водородная связь в ДНК
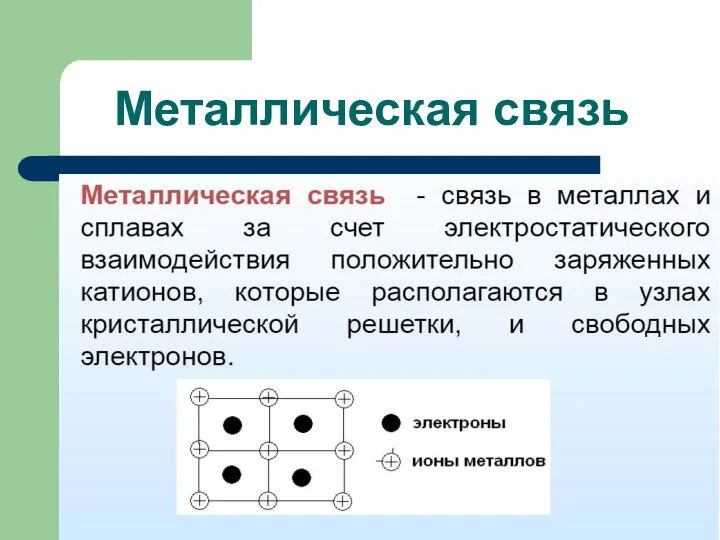
- 88. Металлическая связь
- 89. Металлическая связь Особенности 1.Высокая электропроводность и теплопроводность. 2. Высокое координационное число атомов.
- 90. Металлическая связь Описывают только с помощью ММО - зонной теорией кристаллов. Зона, занятая валентными электронами -
- 91. Металлическая связь Между валентной зоной и зоной проводимости - зона, в которой нет разрешённых уровней –
- 93. Скачать презентацию




























































 Дослідження якісного складу солей. Практична робота №1
Дослідження якісного складу солей. Практична робота №1 Арены. Бензол. Урок химии. 10 класс
Арены. Бензол. Урок химии. 10 класс Зелёная химия
Зелёная химия Кислородсодержащие органические соединения. Спирты
Кислородсодержащие органические соединения. Спирты Көпатомды спирттер. Химиялық қасиеттері
Көпатомды спирттер. Химиялық қасиеттері Свойства органических соединений
Свойства органических соединений Коллигативные свойства растворов
Коллигативные свойства растворов Драгоценные камни
Драгоценные камни Классификация веществ
Классификация веществ Титриметрический анализ
Титриметрический анализ Минералды тыңайтқыштар өндірісі
Минералды тыңайтқыштар өндірісі Білки як високомолекулярні сполуки
Білки як високомолекулярні сполуки Аминокилоты. Свойства
Аминокилоты. Свойства Синтетические моющие средства
Синтетические моющие средства Закономерности химических реакций. (Лекция 3)
Закономерности химических реакций. (Лекция 3) Вода на Земле. Строение молекулы воды
Вода на Земле. Строение молекулы воды Адсорбция. Механизм адсорбции
Адсорбция. Механизм адсорбции Относительная молекулярная масса вещества. Задачи
Относительная молекулярная масса вещества. Задачи Основные понятия и законы химии
Основные понятия и законы химии Оксиды. Классификация. Химические и физические свойства
Оксиды. Классификация. Химические и физические свойства Амины. Понятие об аминах. Анилин как органическое основание
Амины. Понятие об аминах. Анилин как органическое основание Кислородсодержащие соединения азота
Кислородсодержащие соединения азота Арены
Арены Липиды (Жиры)
Липиды (Жиры) Водород. Общая характеристика, получение, свойства
Водород. Общая характеристика, получение, свойства Ұшқыш уларды оқшаулауды теориялық негіздеу
Ұшқыш уларды оқшаулауды теориялық негіздеу Капиллярная конденсация
Капиллярная конденсация Количественное определение лекарственных веществ
Количественное определение лекарственных веществ