Содержание
- 2. Алканы Основные химические связи у алканов — это ковалентная неполярная связь между атомами углерода (С—С) и
- 3. Физические свойства: Шаблоны презентаций с сайта presentation-creation.ru алканы, в составе молекулы которых от 16 атомов углерода,
- 4. С увеличением количества атомов углерода в структуре молекулы и с ее формой в пространстве связана одна
- 5. Химические свойства: для алканов характерны реакции замещения. Галогенирование Правило Зайцева: водород отщепляется преимущественно от наименее гидрогенизированного
- 6. Реакция нитрования (реакция Коновалова) Дегидрирование (отщепление водорода) Горение(реакция с кислородом)
- 7. Получение алканов: Синтез из оксида углерода (II) и водорода для метана: CO + 3H2 → CH4
- 8. Реакция Вюрца (взаимодействие активных металлов с галогенпроизводными алканов) Метод синтеза симметричных насыщенных углеводородов действием металлического натрия
- 9. Циклоалканы это предельные (насыщенные) углеводороды, которые содержат замкнутый углеродный цикл Общая формула циклоалканов CnH2n, где n≥3
- 10. Пpи ноpмальных условиях С3-С4 – газы, С5 – С16 – жидкости, начиная с С17 – твердые
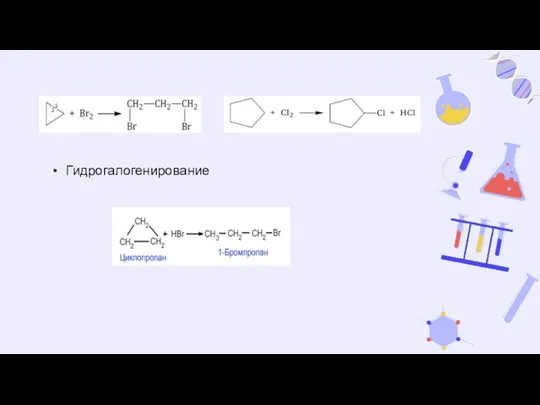
- 11. Химические свойства Гидрирование (присоединение водорода) Галогенирование Циклопропан и циклобутан реагируют с галогенами, при этом тоже происходит
- 12. Гидрогалогенирование
- 14. Скачать презентацию










 Алкадиены, нафтены
Алкадиены, нафтены Аминокислоты
Аминокислоты Биологически важные пяти- и шестичленные гетероциклы с одним и двумя гетероатомами
Биологически важные пяти- и шестичленные гетероциклы с одним и двумя гетероатомами Серная кислота
Серная кислота Фізичні та хімічні властивості кислот (урок хімії у 8 класі)
Фізичні та хімічні властивості кислот (урок хімії у 8 класі) Типы химических реакций , признаки и условия их протекания
Типы химических реакций , признаки и условия их протекания Физико-химия полимеров и их растворов
Физико-химия полимеров и их растворов Азот
Азот Хімічні властивості кислот
Хімічні властивості кислот Поширення солей у природі
Поширення солей у природі Химический потенциал. Фазовые равновесия
Химический потенциал. Фазовые равновесия ПЛАСТИК НОВЫЙ
ПЛАСТИК НОВЫЙ Stirring in liquid media
Stirring in liquid media Литий
Литий Липиды (Жиры)
Липиды (Жиры) В чём соль соли
В чём соль соли Классификация химических реакций по различным основаниям. 9 класс
Классификация химических реакций по различным основаниям. 9 класс Технологии получения полимерных нанокомпозитов
Технологии получения полимерных нанокомпозитов Гетерофазный катализ. (Лекция 20)
Гетерофазный катализ. (Лекция 20) Правила роботи на уроці
Правила роботи на уроці Задачи на процентную концентрацию
Задачи на процентную концентрацию Углероды. Строение и свойства атомов
Углероды. Строение и свойства атомов Спирт µндіру технологиясы
Спирт µндіру технологиясы Решение заданий по теме: Оксиды
Решение заданий по теме: Оксиды Основная. Первоначальные представления об органических веществах
Основная. Первоначальные представления об органических веществах Химические свойства серной кислоты
Химические свойства серной кислоты Никель қаптамаларын алу жолдары
Никель қаптамаларын алу жолдары Полистирол өндірісі
Полистирол өндірісі