Содержание
- 2. Углерод Строение и свойства атома; Аллотропные модификации; Нахождение в природе; Применение; Химические свойства Получение
- 3. Строение и свойства атомов: План: Охарактеризуйте положение углерода в ПСХЭ Д.И. Менделеева(порядковый номер, период, группа) Составьте
- 4. Аллотропные модификации Фуллерен Алмаз Графит
- 5. Аллотропные модификации Алмаз Графит Карбин Лонсдейлит Наноалмаз Фуллерены Фуллерит Углеродное волокно Углеродные нановолокна Углеродные нанотрубки
- 6. Алмаз от греч. «несокрушимый» Данные минералы отличаются особенной твердостью и повышенной износостойкостью, поражают своим необычным блеском,
- 7. Графит от греч. записывать писать Структура слоистая. Хорошо проводит электрический ток. В отличие от алмаза обладает
- 8. Углерод: нахождение в природе
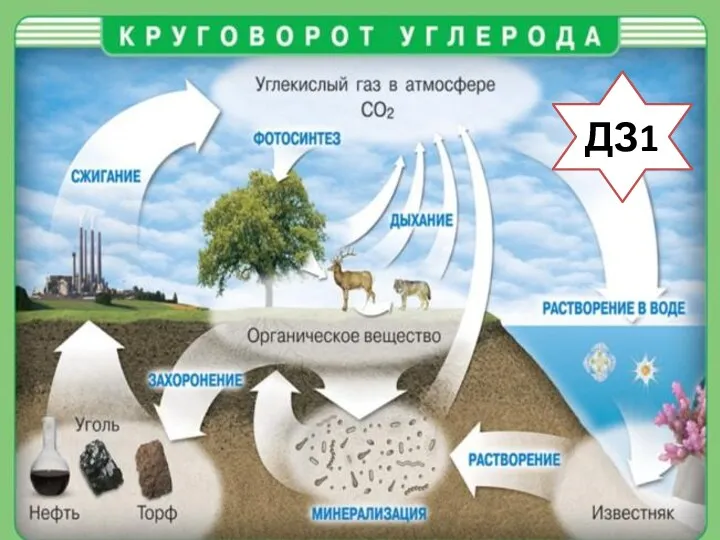
- 9. ДЗ1
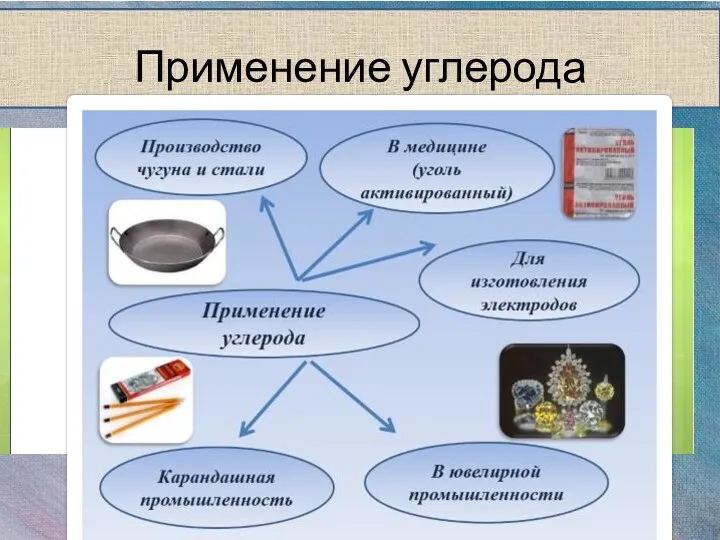
- 10. Применение углерода
- 11. Химические свойства углерода Малоактивен! Вступает в химические реакции только при нагревании. При этом химическая активность углерода
- 12. Качественные реакции на CO3(2-): CO3(-2) + 2H(+) = H2CO3 = CO2↑ + H2O — выделение газа
- 14. Скачать презентацию








 Минерал турмалин
Минерал турмалин Пластмассы: свойства, требования, перспективы развития. Виды конструкций из пластмасс
Пластмассы: свойства, требования, перспективы развития. Виды конструкций из пластмасс Лекарственные средства, относящиеся к производным пиридина : производные никотиновой и изоникотиновой кислоты
Лекарственные средства, относящиеся к производным пиридина : производные никотиновой и изоникотиновой кислоты Искусственные полимеры. 10 класс
Искусственные полимеры. 10 класс Теория химического строения органических соединений
Теория химического строения органических соединений Роль побутової хімії у житті
Роль побутової хімії у житті Методы чтения последовательностей нуклеиновых кислот. Секвенирование геномов древних людей
Методы чтения последовательностей нуклеиновых кислот. Секвенирование геномов древних людей альдегиды, свойства, получение
альдегиды, свойства, получение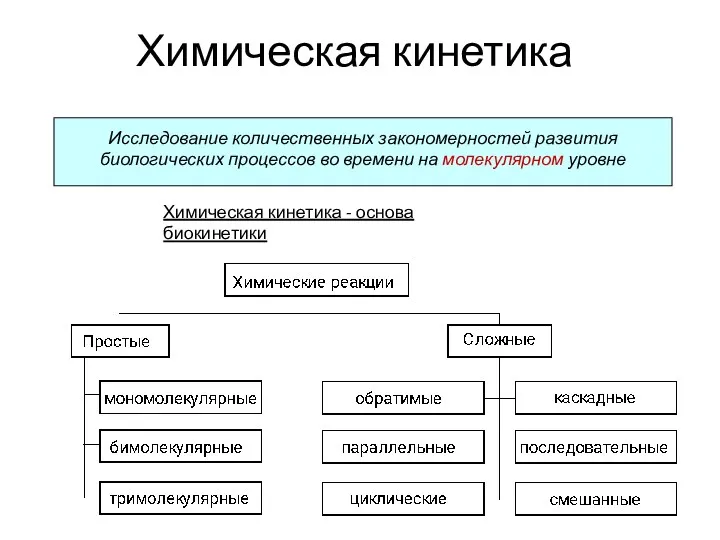 Химическая кинетика
Химическая кинетика Техника безопасности для учащихся в кабинете химии
Техника безопасности для учащихся в кабинете химии Theories of acids and bases. Ionic equilibria in electrolyte solutions. Buffer solutions (topic 3.4)
Theories of acids and bases. Ionic equilibria in electrolyte solutions. Buffer solutions (topic 3.4) Химические и физические свойства воды
Химические и физические свойства воды Окислительно-восстановительные реакции. Готовимся к ЕГЭ
Окислительно-восстановительные реакции. Готовимся к ЕГЭ Ферменты в биотехнологии
Ферменты в биотехнологии Губна помада та ії призначення
Губна помада та ії призначення Анализ двойных диаграмм. Лабораторная работа
Анализ двойных диаграмм. Лабораторная работа Общая характеристика металлов
Общая характеристика металлов Азот и его соединения
Азот и его соединения Обобщение по типам химических реакций
Обобщение по типам химических реакций The production of stable isotopes
The production of stable isotopes Хімічні властивості насичених одноатомних спиртів. Одержання етанолу
Хімічні властивості насичених одноатомних спиртів. Одержання етанолу Protein Chemistry
Protein Chemistry Силикаты. Слюды. Тальк. Фосфаты. Апатит. Крокоит
Силикаты. Слюды. Тальк. Фосфаты. Апатит. Крокоит Хинолин және хинуклидин, 4- жағдайда алмасқан хинолин туындыларының дәрілік заттарын талдау
Хинолин және хинуклидин, 4- жағдайда алмасқан хинолин туындыларының дәрілік заттарын талдау Выращивание кристаллов в домашних условиях
Выращивание кристаллов в домашних условиях Лекция 1 эквивалент 2
Лекция 1 эквивалент 2 Теплові прояви механічної, електричної та хімічної енергії
Теплові прояви механічної, електричної та хімічної енергії Элементы V группы главной подгруппы. Азот. Фосфор. (Лекция 13)
Элементы V группы главной подгруппы. Азот. Фосфор. (Лекция 13)