Содержание
- 2. Азот. Порядковый номер 7. 2 период 5 группа, главная подгруппа.
- 3. Строение азота Символ: N Строение атома и молекулы азота: Элемент II периода группы VA. Заряд ядра
- 4. Нахождение в природе. В природе существуют два стабильных изотопа азота: с массовым числом 14 (99,635%) и
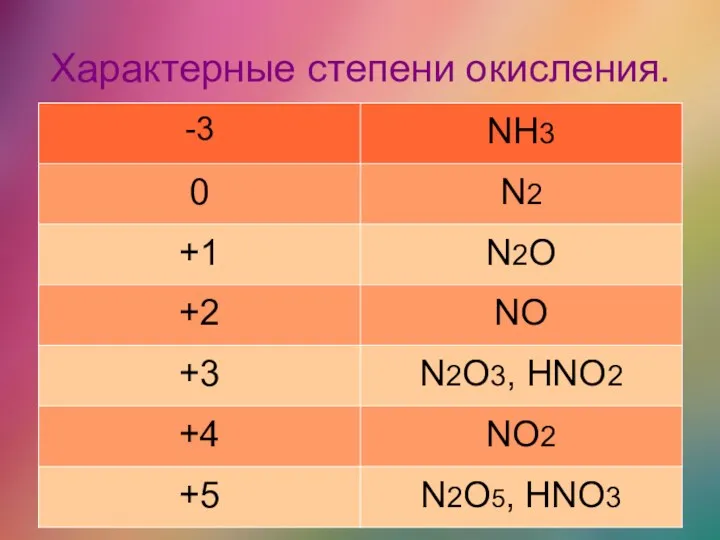
- 5. Характерные степени окисления.
- 6. Физические свойства азота. При обычных условиях газ, без цвета, запаха, вкуса. Плотность по воздуху: Dвоздух(N2) =
- 7. Химические свойства N2. Химически инертен, так как трудно разорвать тройную связь между атомами азота. 1. +
- 8. Химические свойства азота. Очень инертен. Вступает в химические реакции в жестких условиях. 1) При обычных условиях
- 9. Применение азота.
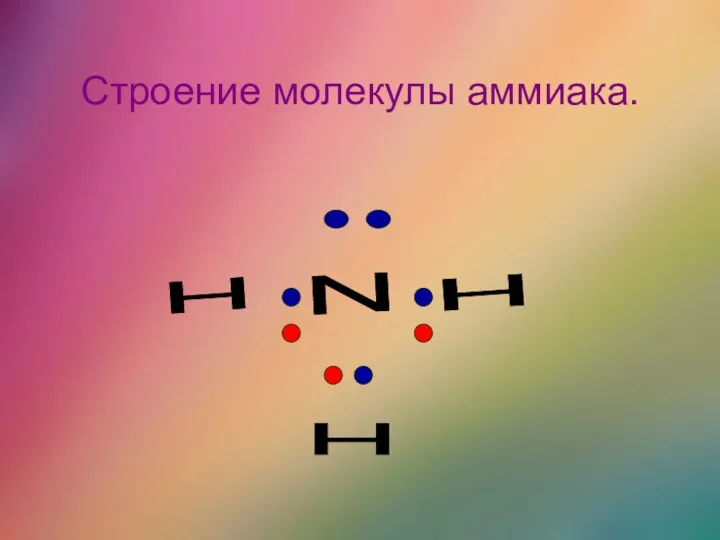
- 10. Строение молекулы аммиака. N H H H
- 13. Получение аммиака. В промышленности Из атмосферного азота N2 + 3H2 ?2NH3 В лаборатории Взаимодействием солей аммония
- 14. Химические свойства аммиака. Проявляет основные свойства: 1. + кислота 2. каталитическое окисление (катализатор- платина) 3. неполное
- 19. Применение аммиака.
- 20. Соли аммония- Соли, в состав которых входит ион NH4+ Обладают свойством разлагаться при нагревании
- 26. Оксиды азота. N2O NO N2O3 NO2 N2O5
- 27. Оксид азота (I) N2O. Закись азота, «веселящий газ». Бесцветный газ со слабым запахом, растворим в воде.
- 28. Оксид азота (II) NO. Бесцветный газ, незначительно растворим в воде, ядовит. Безразличный (несолеобразующий) оксид. Реагирует с
- 29. Оксид азота (III) N2O3. Газ, очень токсичен, вызывает ожоги кожи. неустойчив при обычных условиях взаимодействует с
- 30. Оксид азота (IV) NO2. Газ бурого цвета, тяжелее воздуха, ядовит. Реагирует с водой с образованием азотистой
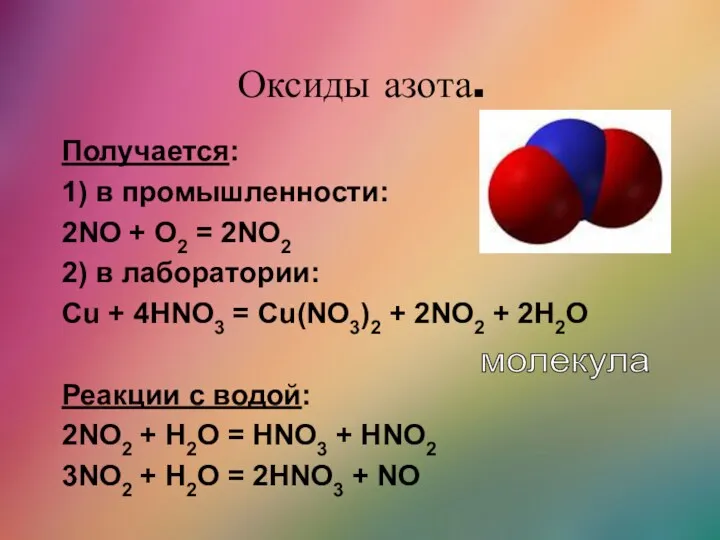
- 31. Оксиды азота. Получается: 1) в промышленности: 2NO + O2 = 2NO2 2) в лаборатории: Cu +
- 32. Оксиды азота. Получение концентрированной азотной кислоты: 4NO2 + 2H2O + O2 = 4HNO3 NO2 обладает сильными
- 33. Фотохимический смог.
- 34. «Лисий хвост»
- 35. Оксид азота (V) N2O5. Кристаллическое вещество, крайне неустойчиво, ядовито. Обладает свойствами кислотного оксида.
- 36. Азотистая кислота HNO2. Очень слабая кислота, легко разлагается. Соли- нитриты.
- 37. Азотная кислота HNO3. Бесцветная жидкость, при хранении приобретает желтоватый оттенок. Дымит на воздухе Гигроскопична. Смешивается с
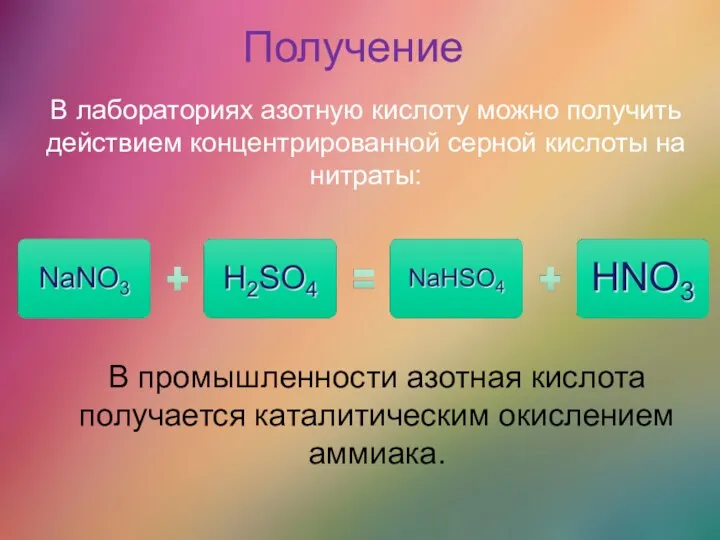
- 38. Получение В лабораториях азотную кислоту можно получить действием концентрированной серной кислоты на нитраты: В промышленности азотная
- 39. Химические свойства I. Разбавленная азотная кислота проявляет свойства, общие для всех кислот: Диссоциация в водном растворе:
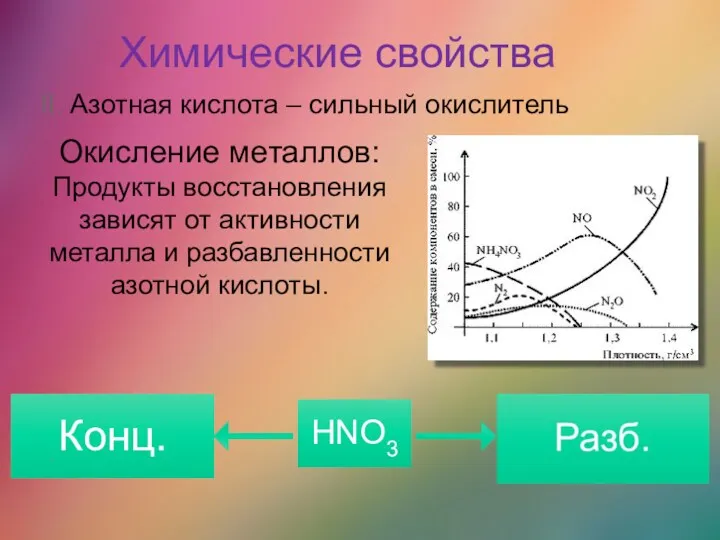
- 40. Химические свойства II. Азотная кислота – сильный окислитель Окисление металлов: Продукты восстановления зависят от активности металла
- 41. Концентрированная HNO3 + металл.
- 42. Разбавленная HNO3 + металл
- 44. Нитраты – соли азотной кислоты (cелитры) Получаются при взаимодействии азотной кислоты с металлами, оксидами металлов, основаниями,
- 45. NaNO3 = Na+ + NO3- Cu(NO3)2 + 2KOH = Cu(OH)2↓ + 2KNO3 AgNO3 + NaCl =
- 46. Разложение нитратов при нагревании.
- 48. Скачать презентацию








































 Қышқылдық-негіздік тепе-теңдік. Қышқылдар мен негіздердің протологиялық теориясы
Қышқылдық-негіздік тепе-теңдік. Қышқылдар мен негіздердің протологиялық теориясы Коррозия материалов
Коррозия материалов Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Ионная химическая связь
Ионная химическая связь Основания и их свойства
Основания и их свойства Галогенопохідні ароматичних вуглеводнів
Галогенопохідні ароматичних вуглеводнів Химия и продукты питания
Химия и продукты питания Гидроксиды. Основания: способы получения
Гидроксиды. Основания: способы получения Химия. Химиялық термодинамика
Химия. Химиялық термодинамика Биофизические основы патологии клетки. Свободные радикалы и болезни человека
Биофизические основы патологии клетки. Свободные радикалы и болезни человека Склад та властивості основних класів неорганічних сполук
Склад та властивості основних класів неорганічних сполук Коррозия металлов и способы защиты от неё. (11 класс)
Коррозия металлов и способы защиты от неё. (11 класс) Хімічні властивості металів
Хімічні властивості металів Газовые законы. Расчетные задачи
Газовые законы. Расчетные задачи Подгруппа Цинка
Подгруппа Цинка Свойства химических элементов I и II А подгрупп периодической системы Д.И. Менделеева
Свойства химических элементов I и II А подгрупп периодической системы Д.И. Менделеева Химия. 6я группа элементов. 9 класс
Химия. 6я группа элементов. 9 класс Введение в химию
Введение в химию Пропан, C3H8
Пропан, C3H8 Азотовмисні та елементоорганічні сполуки
Азотовмисні та елементоорганічні сполуки Предельные и непредельные углеводороды
Предельные и непредельные углеводороды Щелочные и щелочноземельные металлы
Щелочные и щелочноземельные металлы Природный и попутный нефтяной газ
Природный и попутный нефтяной газ Классификация химических реакций
Классификация химических реакций Кислород и его применение
Кислород и его применение Теория строения органических соединений. Лекция 17
Теория строения органических соединений. Лекция 17 Галогены. Положение в ПСХЭ Д.И. Менделеева
Галогены. Положение в ПСХЭ Д.И. Менделеева Анализ лекарственных средств паминофенола, ароматических кислот: бензойная кислота, натрия бензоат, салициловая кислота
Анализ лекарственных средств паминофенола, ароматических кислот: бензойная кислота, натрия бензоат, салициловая кислота