Содержание
- 2. Цель занятия: Изучение этапов формирования органической химии как науки, теории строения органических соединений А. М. Бутлерова
- 3. Задачи: Образовательные: - познакомить курсантов с основными историческими фактами в развитии органической химии; - дать первоначальное
- 4. План: 1. Валентность. Сравнение понятий валентность и степень окисления. 2. Химическое строение как порядок соединения атомов
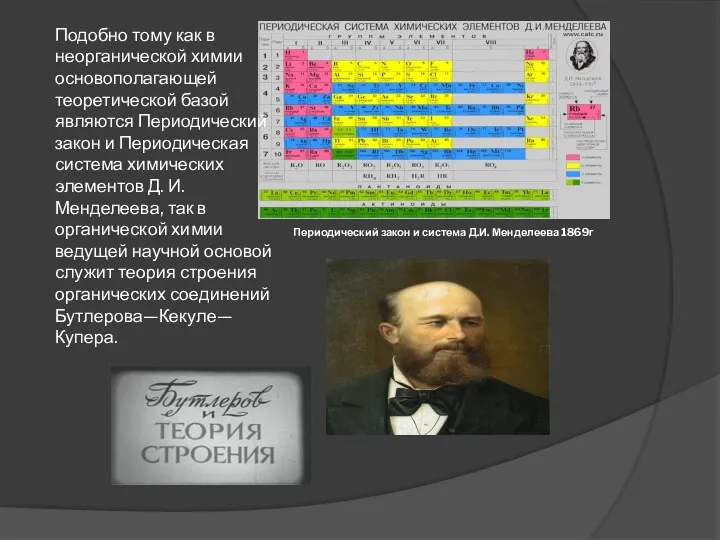
- 5. Периодический закон и система Д.И. Менделеева 1869г Подобно тому как в неорганической химии основополагающей теоретической базой
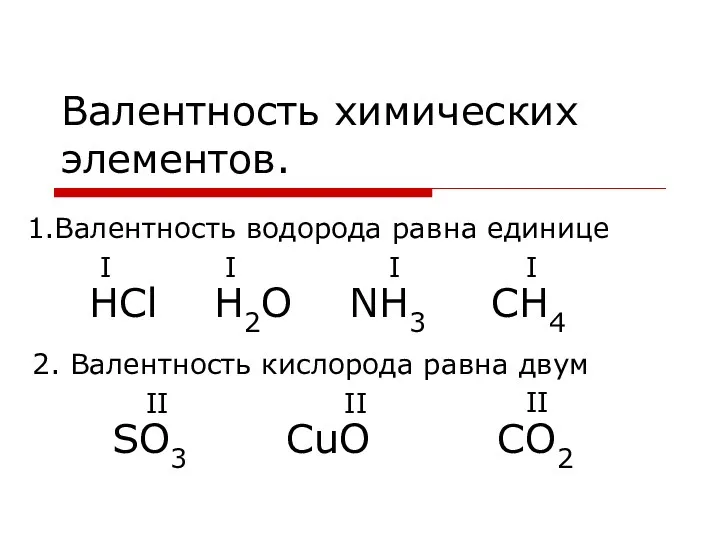
- 6. Валентность Способность атомов химических элементов к образованию химических связей с другими атомами. Она определяет число химических
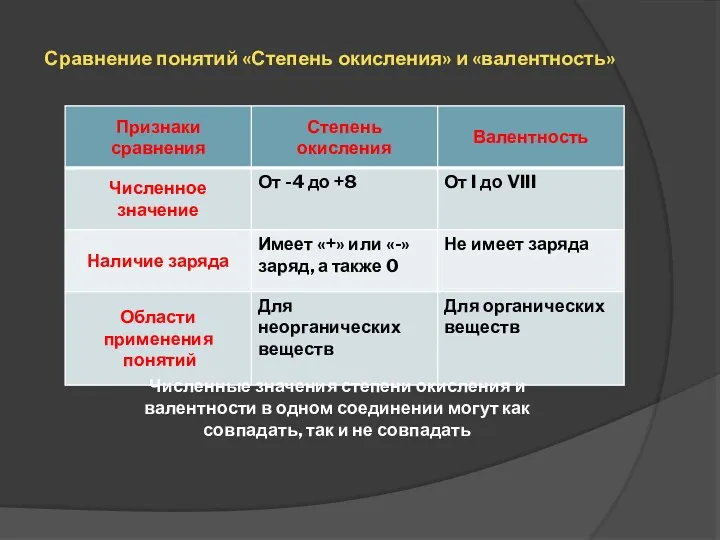
- 7. Сравнение понятий «Степень окисления» и «валентность» Численные значения степени окисления и валентности в одном соединении могут
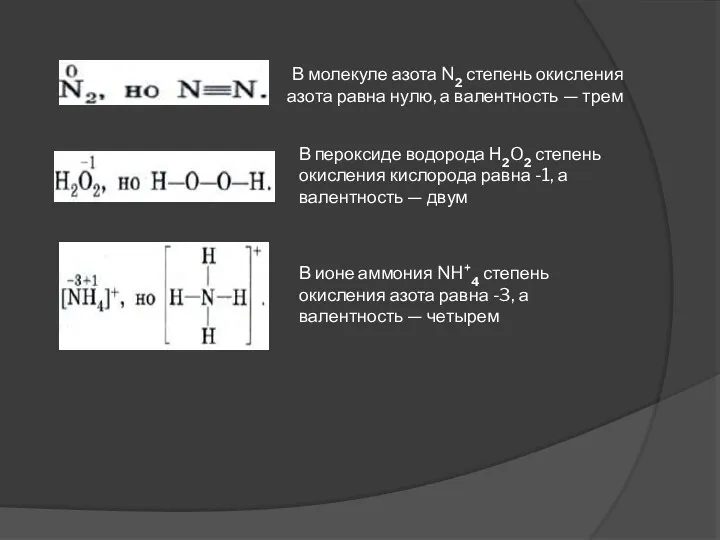
- 8. В молекуле азота N2 степень окисления азота равна нулю, а валентность — трем В пероксиде водорода
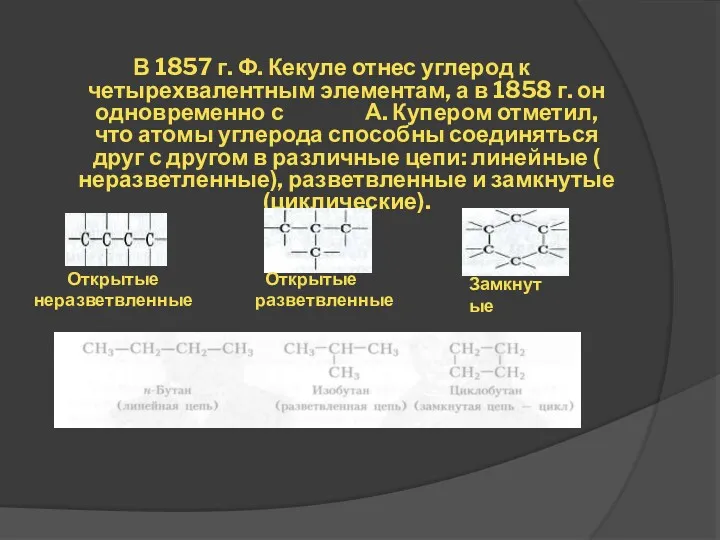
- 9. В 1857 г. Ф. Кекуле отнес углерод к четырехвалентным элементам, а в 1858 г. он одновременно
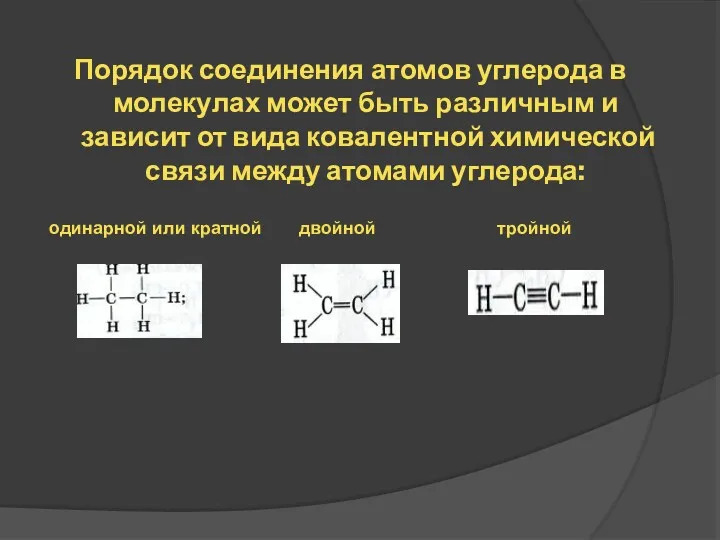
- 10. Порядок соединения атомов углерода в молекулах может быть различным и зависит от вида ковалентной химической связи
- 11. Первое положение теории: Атомы в молекулах веществ соединены в определенной последовательности согласно их валентности. Углерод в
- 12. Ряд веществ, расположенных в порядке возрастания их относительных молекулярных масс, сходных по строению, где каждый член
- 14. Второе положение: Свойства веществ зависят не только от их качественного и количественного состава, но и от
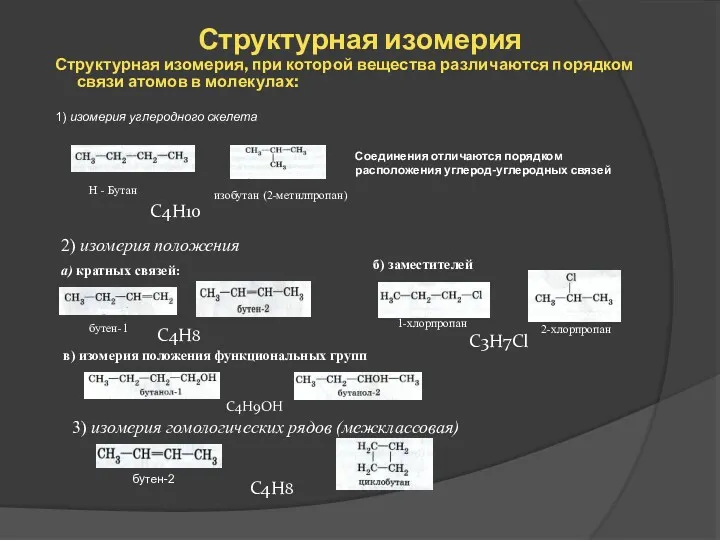
- 15. Виды изомерии: Структурная ( изомерия углеродного скелета; изомерия положения; изомерия гомологических рядов) Пространственная ( цис -,
- 16. Структурная изомерия Структурная изомерия, при которой вещества различаются порядком связи атомов в молекулах: 1) изомерия углеродного
- 17. Пространственная изомерия Геометрическая изомерия характерна, прежде всего, для соединений с двойной углерод-углеродной связью, при которой молекулы
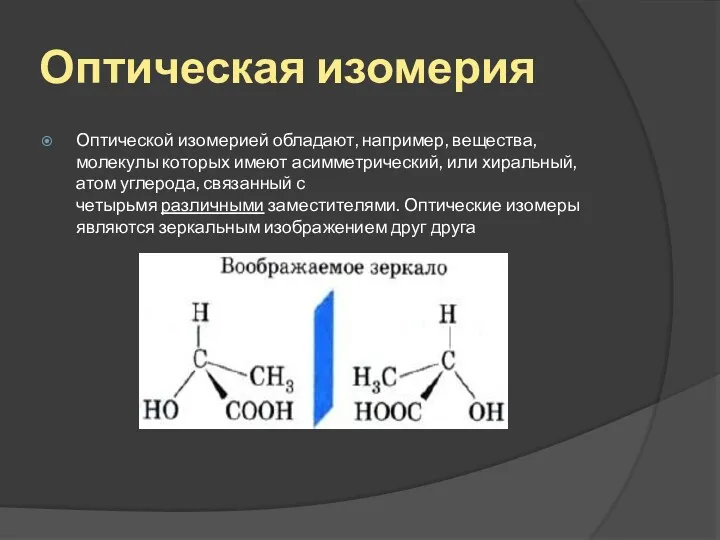
- 18. Оптическая изомерия Оптической изомерией обладают, например, вещества, молекулы которых имеют асимметрический, или хиральный, атом углерода, связанный
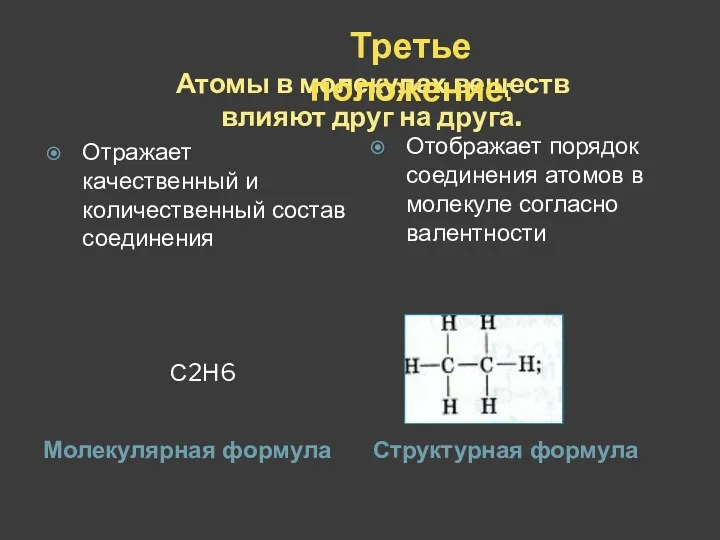
- 19. Молекулярная формула Отражает качественный и количественный состав соединения С2Н6 Отображает порядок соединения атомов в молекуле согласно
- 20. Теория строения органических соединений: объяснила неясности и противоречия в знаниях об органических веществах, творчески обобщила достижения
- 22. Скачать презентацию











 Валентность химических элементов
Валентность химических элементов Азотные удобрения
Азотные удобрения Типичные твердые фазы металлических сплавов
Типичные твердые фазы металлических сплавов Природные и синтетические полимеры
Природные и синтетические полимеры Тема 10- Гетроциклические соединения
Тема 10- Гетроциклические соединения Хинолин. Строение хинолина
Хинолин. Строение хинолина Дисперсные системы
Дисперсные системы Группа веществ, изолируемых из биологического материала дистилляцией
Группа веществ, изолируемых из биологического материала дистилляцией О каком веществе идёт речь?
О каком веществе идёт речь? Пористые адсорбенты. Лекция 06
Пористые адсорбенты. Лекция 06 Көміртек
Көміртек Массовая доля вещества в растворе. 8 класс
Массовая доля вещества в растворе. 8 класс Ауыр металлдар
Ауыр металлдар Сероводород. Сернистый водород, сульфид водорода, дигидросульфид
Сероводород. Сернистый водород, сульфид водорода, дигидросульфид Карбоновые кислоты
Карбоновые кислоты Растворение. Растворы.
Растворение. Растворы. Алкадиены
Алкадиены Кристаллическое состояние вещества в природе
Кристаллическое состояние вещества в природе Окислительные свойства серной и азотной кислот
Окислительные свойства серной и азотной кислот Uses of chlorine and its compounds
Uses of chlorine and its compounds Удивительное вещество - вода
Удивительное вещество - вода Періодична система
Періодична система Ионная химическая связь
Ионная химическая связь Organic molecules
Organic molecules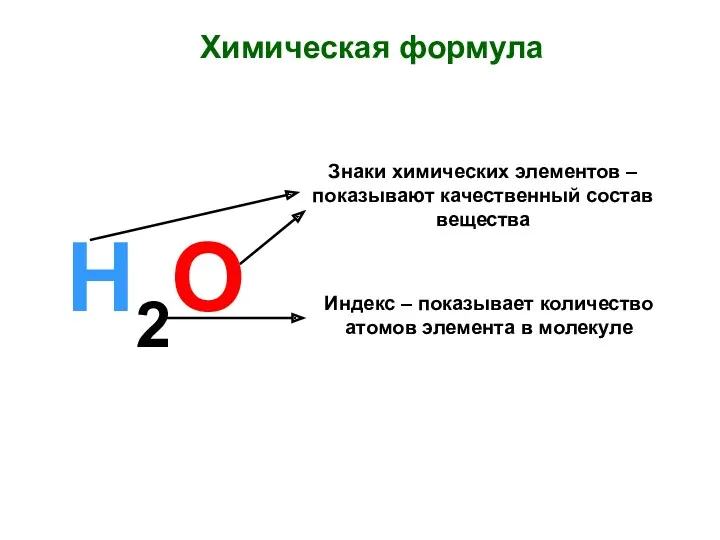 Химическая формула. Знаки химических элементов
Химическая формула. Знаки химических элементов Алюминий. Схема расположения электронов на энергетических подуровнях
Алюминий. Схема расположения электронов на энергетических подуровнях Материалы и изделия на основе полимеров. Лекция 16
Материалы и изделия на основе полимеров. Лекция 16 Поняття про родини хімічних елементів: лужні метали, галогени, інертні елементи. Урок хімії у 8 класі
Поняття про родини хімічних елементів: лужні метали, галогени, інертні елементи. Урок хімії у 8 класі