Поняття про родини хімічних елементів: лужні метали, галогени, інертні елементи. Урок хімії у 8 класі презентация
Содержание
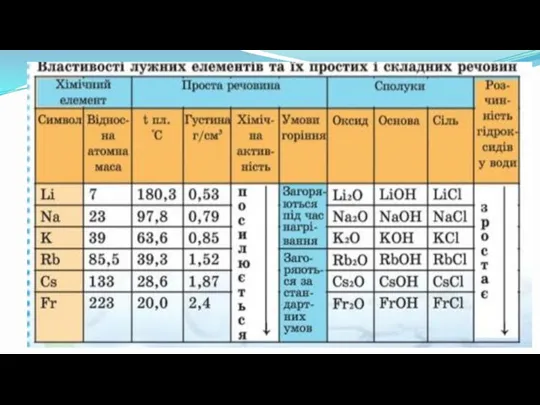
- 2. Що називають лужними металами? Лужні метали – це прості речовини, утворені елементами головних підгруп І групи:
- 3. Ось родина в першій групі Є у головній підгрупі. Це метали надактивні, Інколи аж дуже дивні.
- 4. Фізичні властивості лужних металів Мають металевий блиск, сріблясто-білі (за виключенням цезію - метал золотистого кольору з
- 6. Лужні метали дуже активні, вони легко реагують з киснем повітря, водою, тому зберігаються в банках з
- 7. Прокоментуйте подію, яка сталася у Цюріху перед лекцією професора Вельта. Один зі студентів взяв із виставленої
- 8. Лужні метали активно реагують з киснем. Переглянути відео 4Li + O2 = 2Li2O 4Na + O2
- 9. Лужні метали активно реагують з водою. Переглянути відео З водою літій реагує повільно, натрій значно швидше,
- 10. Прокоментуйте події, що сталися під час досліду Г.Деві Англійський хімік Г. Деві під час електролізу лугу
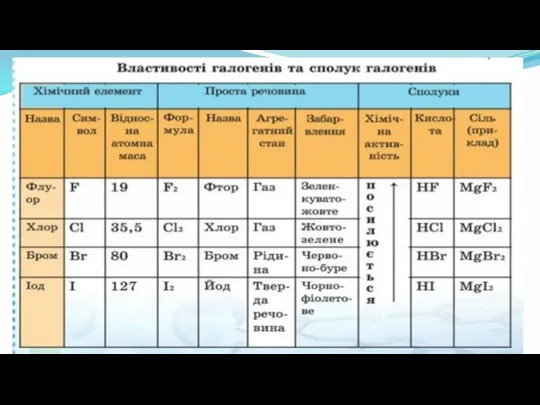
- 11. До галогенів належать F, Cl, Br, I, At Родина галогенів В сьомій групі – галогени, Ніби
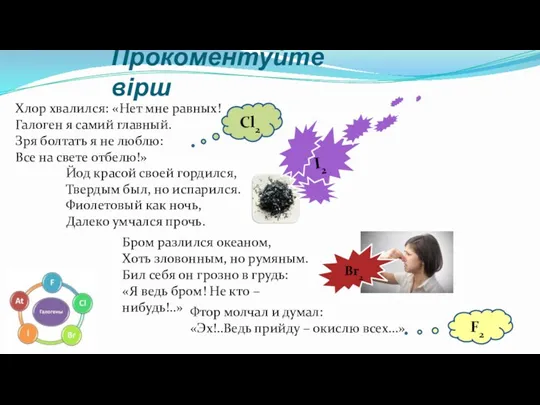
- 13. Прокоментуйте вірш Хлор хвалился: «Нет мне равных! Галоген я самий главный. Зря болтать я не люблю:
- 14. Хімічні властивості галогенів 1. Галогени активно реагують з металами, утворюючі солі. 2Na + Cl2 = 2NaCl
- 15. Родина інертних елементів (благородних газів) До інертних елементів належать Не, Ne, Аr, Кr, Хе, Rn Прості
- 16. Якщо крізь розріджені інертні гази пропускати електричний струм, то вони випромінюють світло різного забарвлення, тому їх
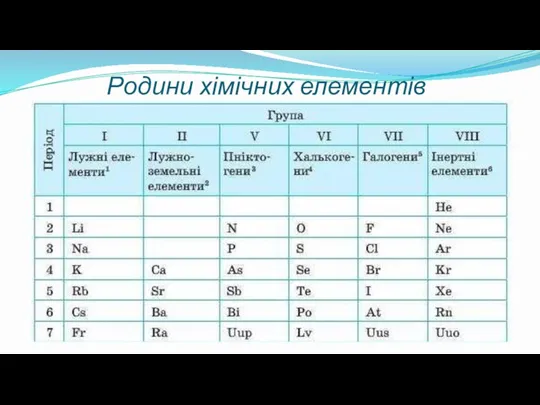
- 17. Родини хімічних елементів
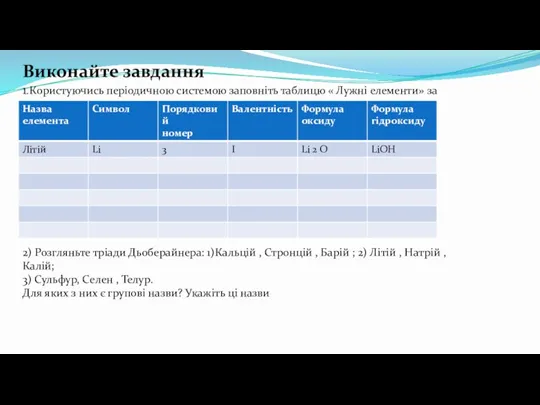
- 18. Виконайте завдання 1.Користуючись періодичною системою заповніть таблицю « Лужні елементи» за зразком 2) Розгляньте тріади Дьоберайнера:
- 20. Скачать презентацию












 Ионоселективные электроды
Ионоселективные электроды Дисперсные системы. Дисперсное состояние вещества. Лекция 10
Дисперсные системы. Дисперсное состояние вещества. Лекция 10 Роль побутової хімії у житті
Роль побутової хімії у житті Мыло. Его состав и моющее действие. Синтетические моющие средства
Мыло. Его состав и моющее действие. Синтетические моющие средства Основні закони хімії.Класи та номенклатура неорганічних сполук
Основні закони хімії.Класи та номенклатура неорганічних сполук Медь и её сплавы
Медь и её сплавы Общая характеристика неметаллов
Общая характеристика неметаллов Химия - тұрмыста
Химия - тұрмыста Металдар арасындағы беттік керіліс
Металдар арасындағы беттік керіліс Теоретические аспекты
Теоретические аспекты Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Коррозия металлов
Коррозия металлов Кристаллические решётки и их виды
Кристаллические решётки и их виды Галогены. Положение в ПСХЭ Д.И. Менделеева
Галогены. Положение в ПСХЭ Д.И. Менделеева Серная кислота H2SO4
Серная кислота H2SO4 Аллотропия
Аллотропия Растворы. Процесс растворения
Растворы. Процесс растворения Общие свойства металлов
Общие свойства металлов Определение качества нефтепродуктов (на примере бензинов и дизельного топлива)
Определение качества нефтепродуктов (на примере бензинов и дизельного топлива) Алкены – непредельные углеводороды. Получение, химические свойства и применение
Алкены – непредельные углеводороды. Получение, химические свойства и применение Актиноиды. Физические и химические свойства
Актиноиды. Физические и химические свойства Электрохимические процессы. Лекция 7
Электрохимические процессы. Лекция 7 Общая характеристика элементов V-А-группы. Азот
Общая характеристика элементов V-А-группы. Азот Задачник. Основные физические величины в химии
Задачник. Основные физические величины в химии Новое направление в бизнесе компании – катализаторы синтеза метанола
Новое направление в бизнесе компании – катализаторы синтеза метанола Сложноэфирная конденсация Кляйзена-Шмидта
Сложноэфирная конденсация Кляйзена-Шмидта Warm-Up
Warm-Up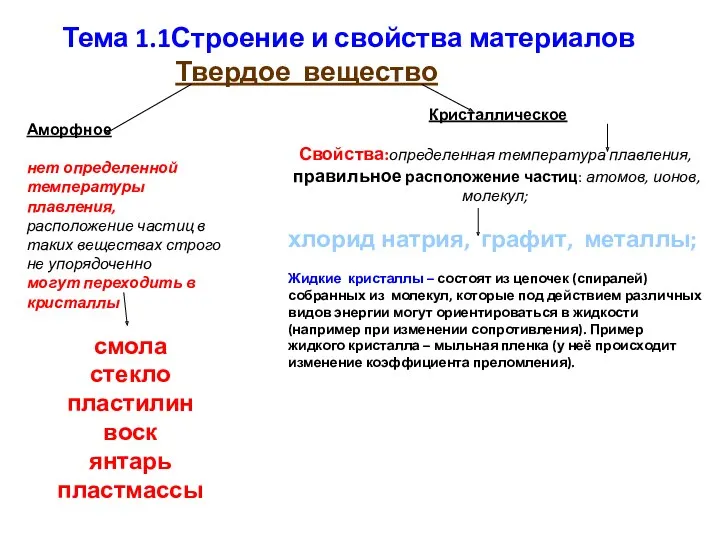 Строение и свойства материалов. Тема 1.1
Строение и свойства материалов. Тема 1.1