Содержание
- 2. Слово коррозия происходит от латинского «corrodere», что означает разъедать. . По данным Института физической химии РАН,
- 3. Ущерб, наносимый коррозией Мировая потеря 20 млн. тонн металла в год Еще более значимы косвенные потери
- 4. В III до нашей эры на острове Родос был построен маяк в виде огромной статуи Гелиоса.
- 5. Что является символом Парижа? –Эйфелева башня. Она неизлечима больна, ржавеет и разрушается, и только постоянная химиотерапия
- 6. Хотя коррозию чаще всего связывают с металлами, но ей подвергаются также камни, пластмассы и другие полимерные
- 7. Таким образом, коррозия - самопроизвольный процесс разрушения материалов и изделий из них под химическим воздействием окружающей
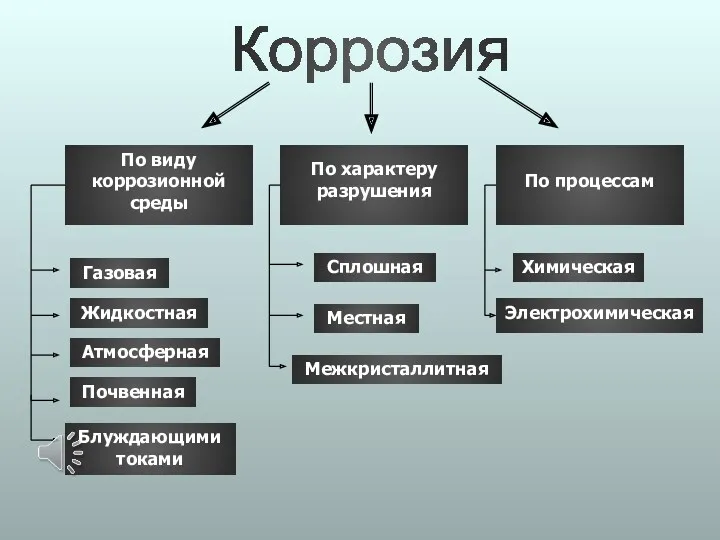
- 8. Виды коррозии
- 9. Коррозия По виду коррозионной среды По характеру разрушения По процессам Газовая Жидкостная Атмосферная Почвенная Сплошная Местная
- 10. По виду коррозионной среды
- 11. Газовая Атмосферная Жидкостная Почвенная Блуждающими токами
- 12. По характеру разрушений
- 13. Сплошная коррозия Равномерная Неравномерная
- 14. Местная коррозия Язвенная Точечная Пятнами
- 15. Причины возникновения местной коррозии Соль на дорогах Морская вода Межкристаллитная коррозия
- 16. По процессам
- 17. Химическая коррозия Химическая коррозия – самопроизвольное разрушение металлов в среде окислительного газа (кислорода, галогенов и т.д.)
- 18. Химическая коррозия не сопровождается возникновением электрического тока. Она основана на реакции между металлом и агрессивным реагентом.
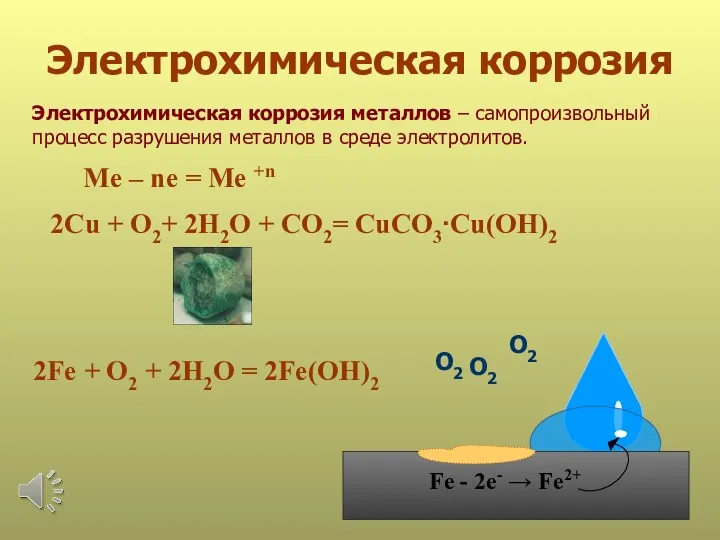
- 19. Электрохимическая коррозия Электрохимическая коррозия металлов – самопроизвольный процесс разрушения металлов в среде электролитов. 2Fe + O2
- 20. Закономерности коррозии: 1. Если соединены два разных металла, то коррозии подвергается только более активный, и пока
- 21. 2. Скорость коррозии тем больше, чем дальше друг от друга в ряду напряжений расположены соединённые металлы.
- 22. Разрушение железа, покрытого медью в кислой среде
- 23. Строго отделить химическую коррозию от электрохимической трудно, а иногда и невозможно. Дело в том, что электрохимическая
- 24. Защита металлов от коррозии
- 25. Нанесение защитных покрытий Пластмасса Краска Лак Грунтовка Смола Эмаль Масло
- 26. Позолота Покрытие антикоррозионным металлом Лужение Покрытие алюминием Покрывающие металлы сами корродируют с малой скоростью, так как
- 27. Покрытие антикоррозионным металлом Хромирование Никелирование Оцинковка
- 28. Создание сплавов с антикоррозионными свойствами. Для этого в основной металл добавляют до 12% хрома, никеля, кобальта
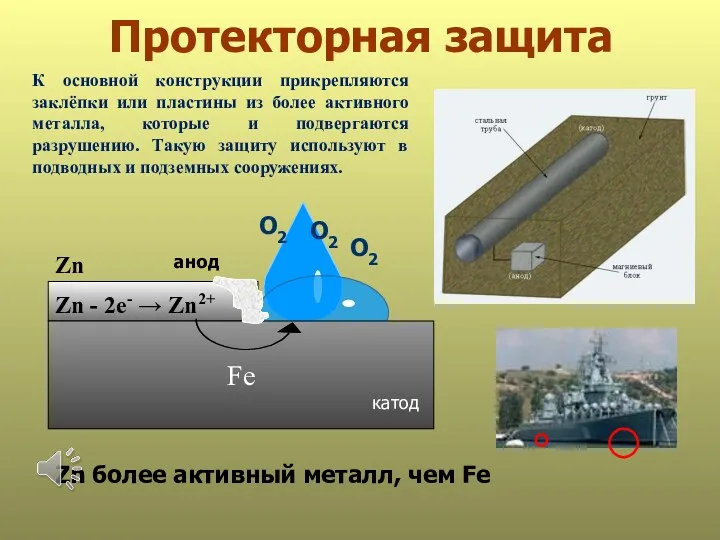
- 29. Протекторная защита анод Fe О2 О2 Zn - 2е- → Zn2+ катод Zn более активный металл,
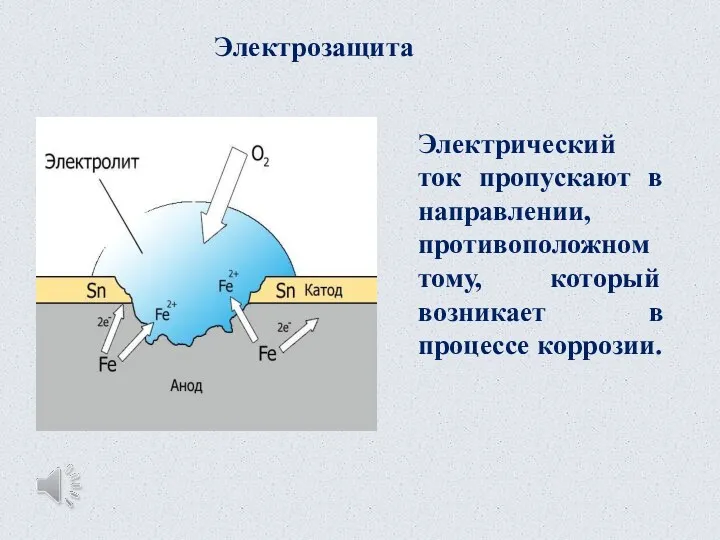
- 30. Электрозащита Электрический ток пропускают в направлении, противоположном тому, который возникает в процессе коррозии.
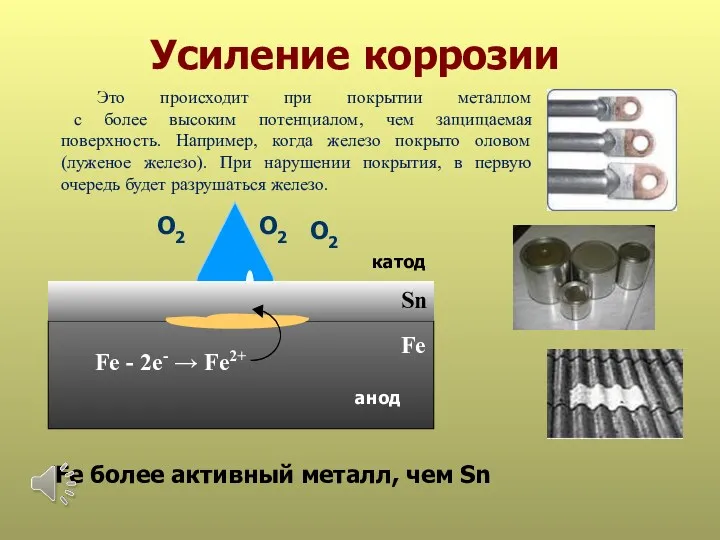
- 31. Усиление коррозии Sn анод катод Fe - 2е- → Fe2+ Fe Fe более активный металл, чем
- 32. Применение ингибиторов Ингибиторы - это вещества, способные замедлять протекание химических процессов или останавливать их. Известно более
- 33. Известно, что дамасские мастера для снятия окалины и ржавчины пользовались растворами серной кислоты с добавками пивных
- 34. Задача 1 Сантехника попросили поставить водопроводный кран, на стальную трубу. В наличии оказались хромированный и медный
- 35. Задача 2 Человек поставил на зуб золотую коронку, по истечении некоторого времени возникла необходимость в еще
- 37. Скачать презентацию





























 Галогены
Галогены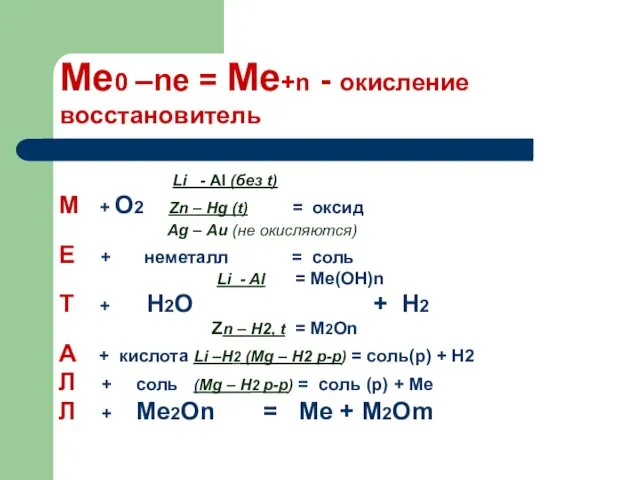 Коррозия металлов
Коррозия металлов Заключительный урок в 8 классе Тест по химии.
Заключительный урок в 8 классе Тест по химии. Технология производства сложных полиэфиров
Технология производства сложных полиэфиров Вред Coca-Cola на организм человека
Вред Coca-Cola на организм человека Оксиды и гидроксиды металлов. 11 класс
Оксиды и гидроксиды металлов. 11 класс Непредельные углеводороды
Непредельные углеводороды Аммиак
Аммиак Мыло
Мыло Олово и свинец
Олово и свинец Судың диссоциациялануы. Сутектік көрсеткіш. Тұздар гидролизі
Судың диссоциациялануы. Сутектік көрсеткіш. Тұздар гидролизі Химия в сельском хозяйстве. Химизация сельского хозяйства и ее направления
Химия в сельском хозяйстве. Химизация сельского хозяйства и ее направления Ультраосновные породы (гипербазиты)
Ультраосновные породы (гипербазиты) Коррозия металлов
Коррозия металлов Строение атома. Периодический закон и периодическая система элементов
Строение атома. Периодический закон и периодическая система элементов Кислородные соединения азота
Кислородные соединения азота Карбоновые кислоты
Карбоновые кислоты Total Synthesis of Aplysiasecosterol A
Total Synthesis of Aplysiasecosterol A Кислоты и основания. (Лекция 16)
Кислоты и основания. (Лекция 16) Stirring in liquid media
Stirring in liquid media Химия в быту
Химия в быту Ископаемые углеводороды
Ископаемые углеводороды NaHSO4. Гидросульфат натрия
NaHSO4. Гидросульфат натрия Современные тенденции развития химии
Современные тенденции развития химии Иондық байланыс
Иондық байланыс Вклад ученых-химиков в победу в Великой Отечественной войне
Вклад ученых-химиков в победу в Великой Отечественной войне ЕГЭ по химии. Анализ результатов решения (часть 2)
ЕГЭ по химии. Анализ результатов решения (часть 2) Органические и неорганические кислоты
Органические и неорганические кислоты