Содержание
- 2. Цели урока: закрепить знания о классификации и номенклатуре; химических свойствах основных оксидов и гидроксидов металлов, научить
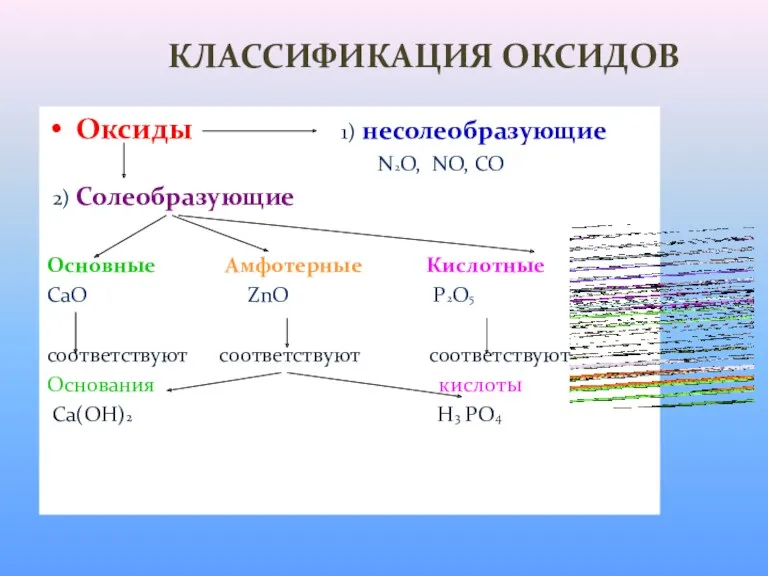
- 3. КЛАССИФИКАЦИЯ ОКСИДОВ Оксиды 1) несолеобразующие N2O, NO, CO 2) Солеобразующие Основные Амфотерные Кислотные CaO ZnO P2O5
- 4. Кислотные оксиды Кислотные оксиды - это оксиды, которые реагируют со щелочами с образованием соли и воды,
- 5. Основные оксиды Основные оксиды - это оксиды, которые реагируют с кислотами с образованием соли и воды,
- 6. Физические свойства
- 8. Амфотерные оксиды Эти оксиды проявляют двойные свойства, т.е свойства и кислотных, и основных оксидов. Значит, они
- 9. Несолеобразующие безразличные оксиды не реагируют с образованием солей ни с кислотами, ни со щелочами. К такому
- 10. Ответь на вопросы 1Ряд веществ, являющихся оксидами . 2Ряд основных оксидов. 3 Ряд амфотерных оксидов:
- 11. Ответь на вопросы 4 Ряд кислотных оксидов: 5 Ряд несолеобразующих оксидов:
- 12. Установите соответствие между формулами оксидов и характером их свойств.
- 13. Проверь себя 1-Г 2-Б 3-В 4-Б 5-В 6 1А 2В 3Д 4Б
- 14. ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫХ ОКСИДОВ (О.О.) 1) О.О. + кислота =соль + вода (реакция обмена) CaO +
- 15. Химические свойства 4. Взаимодействие с амфотерными оксидами: СaO + Al2O3 → Сa(AlO2)2 5.Многие основные оксиды могут
- 16. Химические свойства Оксиды благородных металлов и ртути разлагаются при нагревании: 2Ag2O → 4Ag + O2 2HgO
- 17. Тренировочные упражнения K --> K2O --> KOH --> K2SO4 1. К + O2 = КО2 2.
- 19. Определения Гидроксиды – это электролиты, в результате диссоциации их водных растворов образуется толь один вид анионов:
- 20. Классификация гидроксидов ·По растворимости в воде гидроксиды делятся на: К растворимым гидроксидам относятся гидроксиды щелочных и
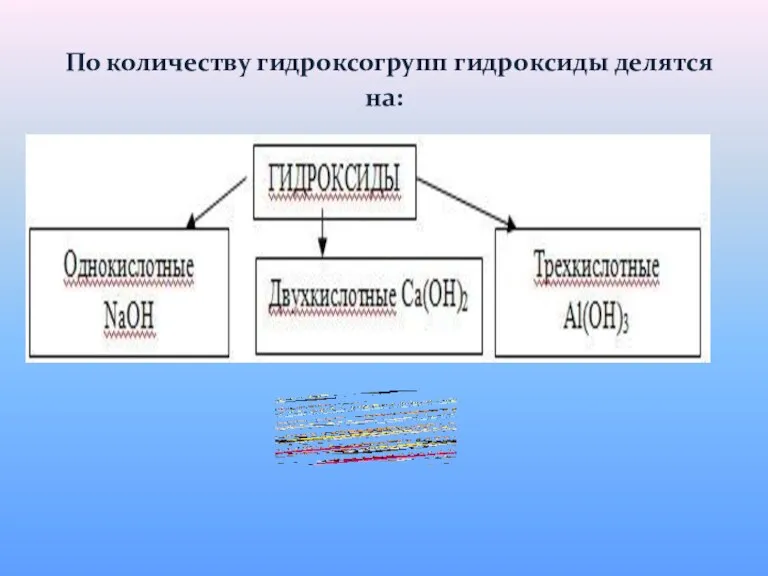
- 21. По количеству гидроксогрупп гидроксиды делятся на:
- 22. Физические свойства Гидроксиды щелочных металлов при обычных условиях – это твердые белые вещества, гигроскопичны и очень
- 23. Химические свойства 1. Реакция с кислотами. Все гидроксиды реагируют с кислотами с образованием соли и воды.
- 24. 2. Реакция с кислотными оксидами. 2KOH + CO2 = K2CO3 + H2O
- 25. 3. Реакция с солями. Щелочи реагируют с растворами солей, если в результате реакции один из продуктов
- 26. Химические свойства Разложение при нагревании. Нерастворимые гидроксиды при нагревании разлагаются на соответствующий оксид и воду. Cu
- 27. Зарядка для глаз ( вверх вниз по ступеням, считаем фонари зигзагами)
- 28. Основные способы получения гидроксидов 1. Щелочи можно получить при взаимодействии соответствующих металлов с водой. K +
- 29. Получение 2. Щелочи можно получить при взаимодействии оксидов щелочных и щелочноземельных металлов с водой. BaO +
- 30. Получение 4. Нерастворимые и амфотерные гидроксиды получают в основном обменными реакциями солей соответствующего металла со щелочью.
- 31. Получение 5. Нерастворимые гидроксиды можно получить при необратимом гидролизе некоторых солей. 2Al(NO3)3 + 3Na2S +6H2O →
- 32. Домашнее задание Параграф №
- 34. Скачать презентацию





























 Пестициды. Лекция
Пестициды. Лекция Энергетическое топливо
Энергетическое топливо Степень окисления
Степень окисления Химиялық өнеркәсіп шикізаты . Шикізат көздері Химиялық өндірістегі энергия және энергия көздері
Химиялық өнеркәсіп шикізаты . Шикізат көздері Химиялық өндірістегі энергия және энергия көздері Мыльная история. (3 класс)
Мыльная история. (3 класс) Соединения кремния
Соединения кремния Получение азотной кислоты
Получение азотной кислоты Знакомство с лабораторным оборудованием
Знакомство с лабораторным оборудованием Получение галогенов. Биологическое значение и применение галогенов
Получение галогенов. Биологическое значение и применение галогенов Биохимия. Лекция 7. Углеводы
Биохимия. Лекция 7. Углеводы Total Synthesis of (−) - Lepenine
Total Synthesis of (−) - Lepenine Стали и чугуны. Классификация и маркировка
Стали и чугуны. Классификация и маркировка Подгруппа азота. 9 класс
Подгруппа азота. 9 класс Щелочи
Щелочи Азотная кислота и нитраты
Азотная кислота и нитраты Жёсткость воды и способы её устранения
Жёсткость воды и способы её устранения Ерітінділер туралы ілім. Буферлік ерітінділер
Ерітінділер туралы ілім. Буферлік ерітінділер Redox Reactions
Redox Reactions Строение атомов. Понятие о квантовой механике
Строение атомов. Понятие о квантовой механике Технология производства хлорбензола
Технология производства хлорбензола Химиялық реакция белгілерін атаңыз
Химиялық реакция белгілерін атаңыз Коррозия металлов
Коррозия металлов МЫШЬЯК
МЫШЬЯК Относительная молекулярная масса
Относительная молекулярная масса Установление структуры биополимеров
Установление структуры биополимеров Классификация строительных материалов. Коррозия бетона и железобетона
Классификация строительных материалов. Коррозия бетона и железобетона Биофизическая химия. Предмет и задачи курса
Биофизическая химия. Предмет и задачи курса Буферное кислотно - основное взаимодействие
Буферное кислотно - основное взаимодействие