Содержание
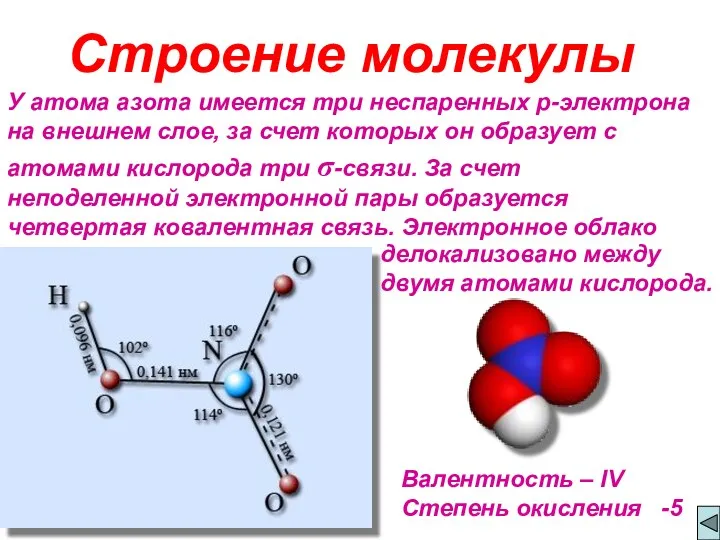
- 2. У атома азота имеется три неспаренных p-электрона на внешнем слое, за счет которых он образует с
- 3. Физические свойства Бесцветная жидкость, дымящая на воздухе. Едкий запах. Желтый цвет концентрированной кислоты (разложение с образованием
- 4. Химические свойства Разбавленная азотная кислота проявляет свойства, общие для всех кислот: Диссоциация в водном растворе: HNO3
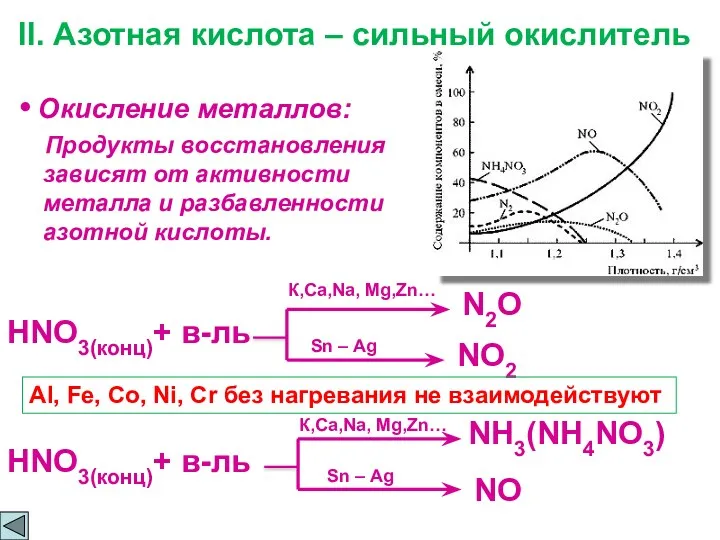
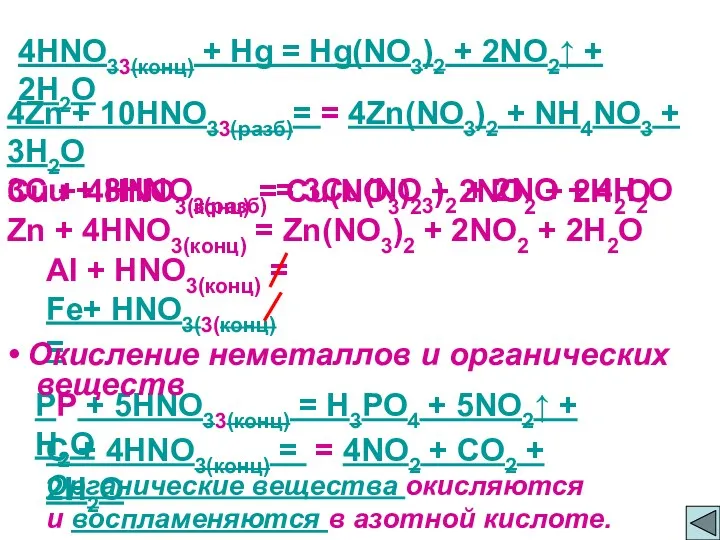
- 5. Окисление металлов: Продукты восстановления зависят от активности металла и разбавленности азотной кислоты. HNO3(конц)+ в-ль II. Азотная
- 6. 4HNO33(конц) + Hg = Hg(NO3)2 + 2NO2↑ + 2H2O 4Zn + 10HNO33(разб)= = 4Zn(NO3)2 + NH4NO3
- 7. Получение азотной кислоты В промышленности – окислением аммиака: 4NH3 + 5O2 = 4NO + 6H2O 2NO
- 8. Нитраты – соли азотной кислоты (cелитры) Получаются при взаимодействии азотной кислоты с металлами,оксидами металлов, основаниями, аммиаком
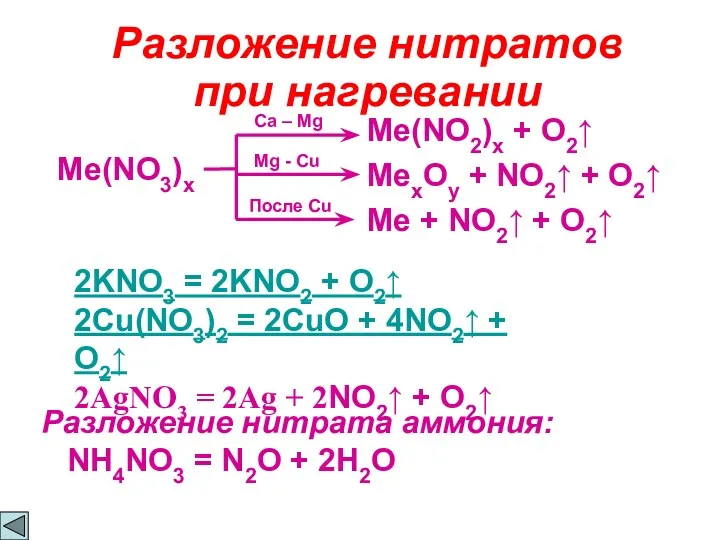
- 9. Разложение нитратов при нагревании Me(NO3)x Ca – Mg Me(NO2)x + O2↑ Mg - Cu MexOy +
- 10. Качественные реакции на азотную кислоту и ее соли NaNO3 + H2SO4 = NaHSO4 + HNO3 4HNO3
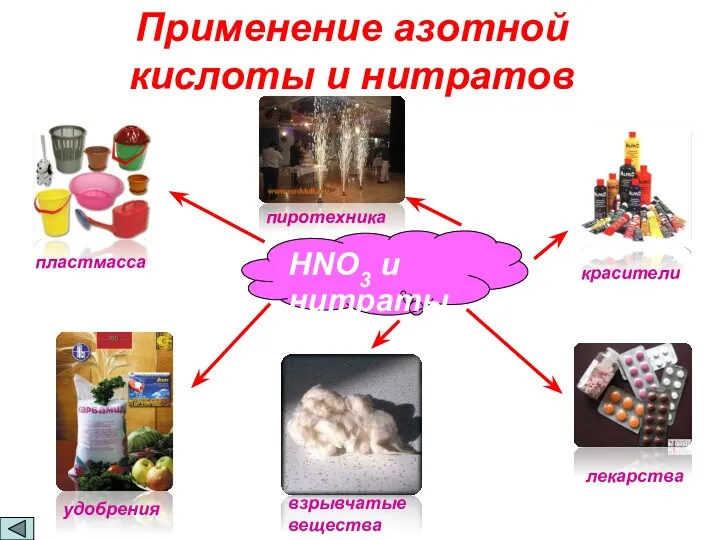
- 11. красители лекарства удобрения пластмасса пиротехника взрывчатые вещества Применение азотной кислоты и нитратов HNO3 и нитраты
- 13. Скачать презентацию





 Окислительно-восстановительные реакции. 11 класс
Окислительно-восстановительные реакции. 11 класс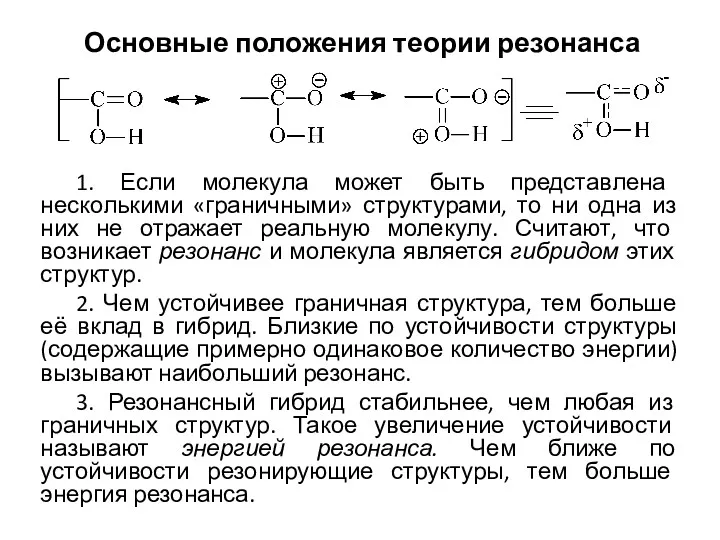 Основные положения теории резонанса
Основные положения теории резонанса Сера и ее соединения
Сера и ее соединения Массовая доля химического элемента
Массовая доля химического элемента Вяжущие вещества
Вяжущие вещества Химическая промышленность России
Химическая промышленность России Гідроліз солей
Гідроліз солей Целевой и содержательный компоненты процесса обучения химии
Целевой и содержательный компоненты процесса обучения химии Химическая термодинамика. Термохимия
Химическая термодинамика. Термохимия Химический элемент кремний
Химический элемент кремний Полимеры, бумага
Полимеры, бумага Количество вещества. Моль
Количество вещества. Моль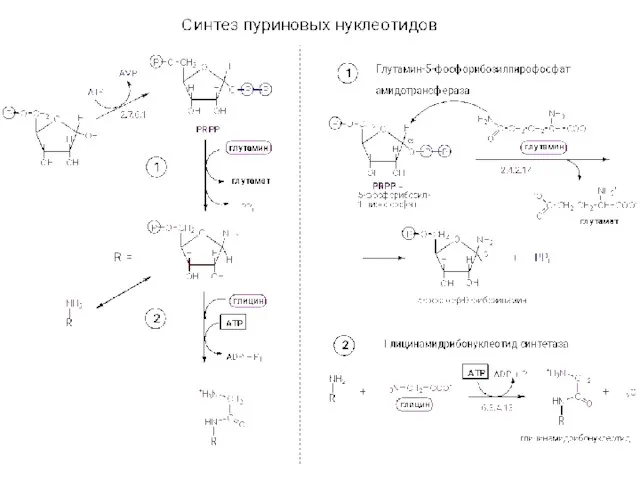 Синтез нуклеотидов
Синтез нуклеотидов Практическая работа №1. Приготовление раствора с определенной массовой долей соли
Практическая работа №1. Приготовление раствора с определенной массовой долей соли Целлюлоза
Целлюлоза Алкины. Ацетилены
Алкины. Ацетилены Введение в химическую термодинамику
Введение в химическую термодинамику Biomass Feedstocks
Biomass Feedstocks Коллигативные свойства растворов
Коллигативные свойства растворов Химические свойства простых металлов, неметаллов и оксидов. Задание 6 по ЕГЭ
Химические свойства простых металлов, неметаллов и оксидов. Задание 6 по ЕГЭ Смолы и бальзамы. Воски и структурообразующие вещества в косметическом производстве
Смолы и бальзамы. Воски и структурообразующие вещества в косметическом производстве Процессы и технологическая схема производства сегодня. АО Газпромнефть-ОНПЗ
Процессы и технологическая схема производства сегодня. АО Газпромнефть-ОНПЗ Презентация по химии _Классификация веществ_ 11 класс
Презентация по химии _Классификация веществ_ 11 класс Тренинг. Практическая химия (8-9 классы)
Тренинг. Практическая химия (8-9 классы) Лекция 7. Кислотно-основное равновесие в растворах
Лекция 7. Кислотно-основное равновесие в растворах Алканы. Гомологи
Алканы. Гомологи Контроль качества пищевых товаров
Контроль качества пищевых товаров Электрохимические процессы
Электрохимические процессы