Содержание
- 2. Ароматичность. Арены Определение и классификация Арены, не смотря на свою «ненасыщенность», в отличие от алифатических непредельных
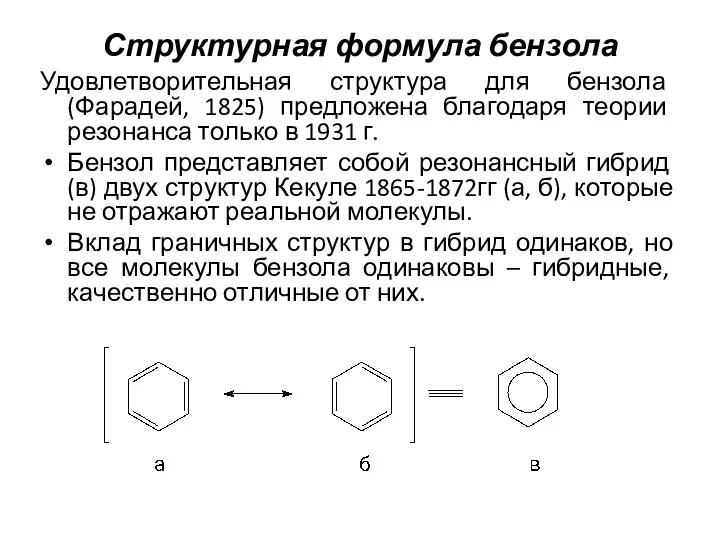
- 3. Структурная формула бензола Удовлетворительная структура для бензола (Фарадей, 1825) предложена благодаря теории резонанса только в 1931
- 4. Структурная формула бензола (2) Все С – С – связи бензола одинаковы («гибридные») и называются полуторными
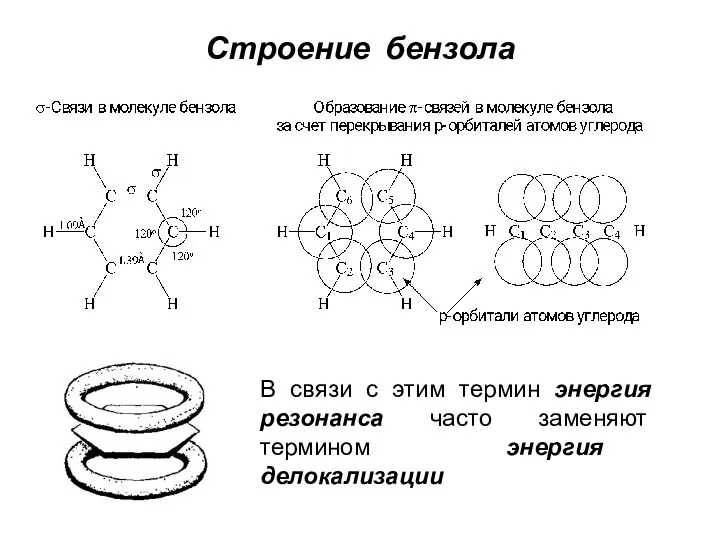
- 5. Строение бензола В связи с этим термин энергия резонанса часто заменяют термином энергия делокализации
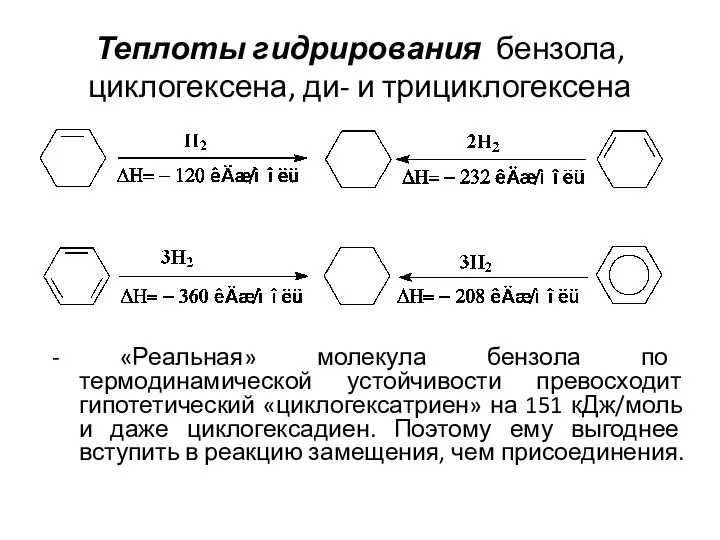
- 6. Теплоты гидрирования бензола, циклогексена, ди- и трициклогексена - «Реальная» молекула бензола по термодинамической устойчивости превосходит гипотетический
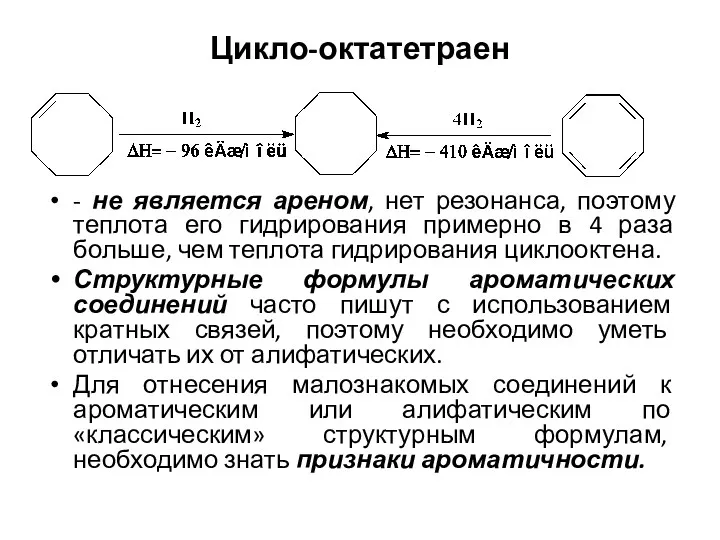
- 7. Цикло-октатетраен - не является ареном, нет резонанса, поэтому теплота его гидрирования примерно в 4 раза больше,
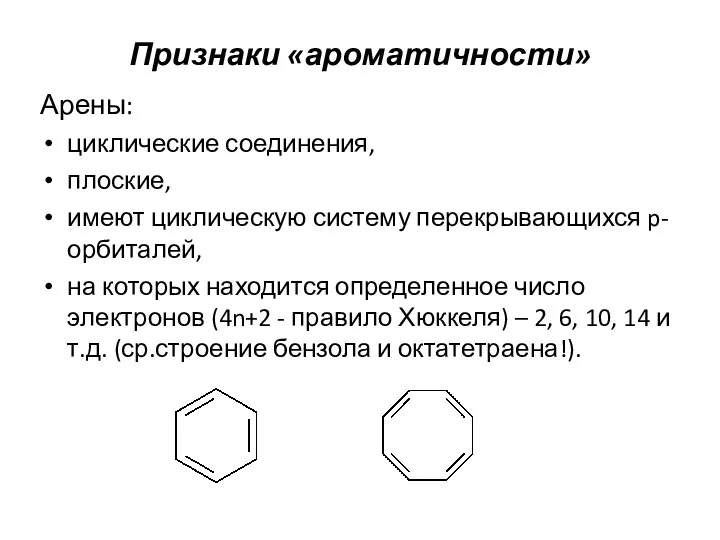
- 8. Признаки «ароматичности» Арены: циклические соединения, плоские, имеют циклическую систему перекрывающихся p-орбиталей, на которых находится определенное число
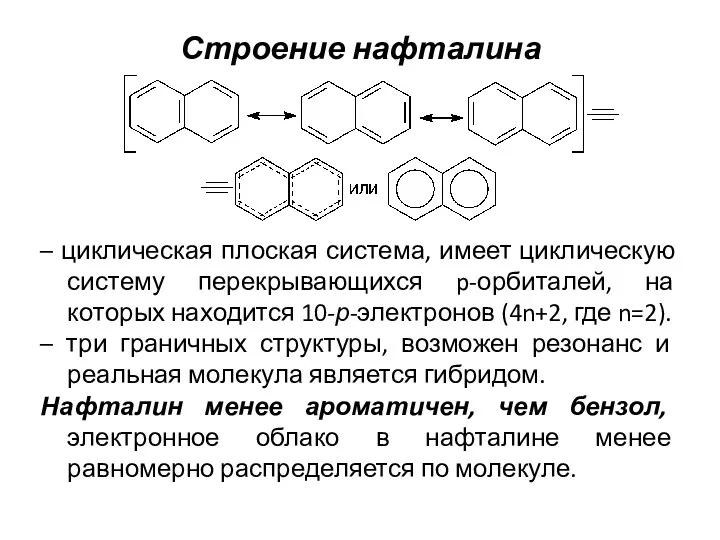
- 9. Строение нафталина – циклическая плоская система, имеет циклическую систему перекрывающихся p-орбиталей, на которых находится 10-р-электронов (4n+2,
- 10. Взаимодействие заместителей с электронным облаком бензола Атомы и группы атомов, связанные с аренами, активно влияют на
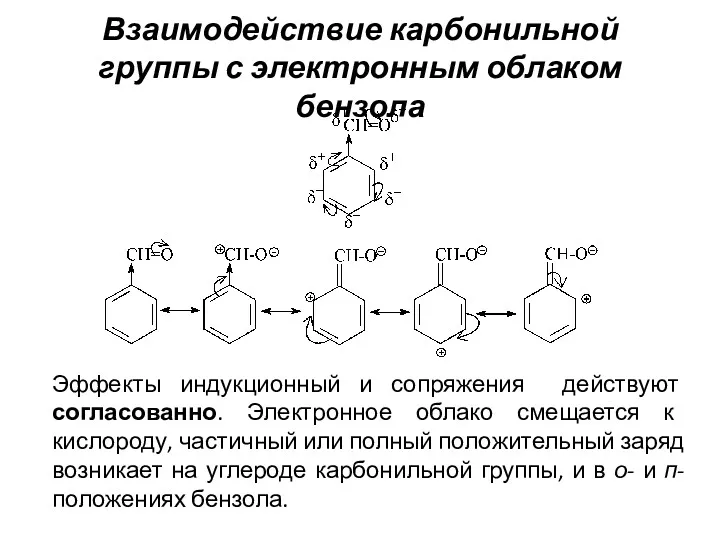
- 11. Взаимодействие карбонильной группы с электронным облаком бензола Эффекты индукционный и сопряжения действуют согласованно. Электронное облако смещается
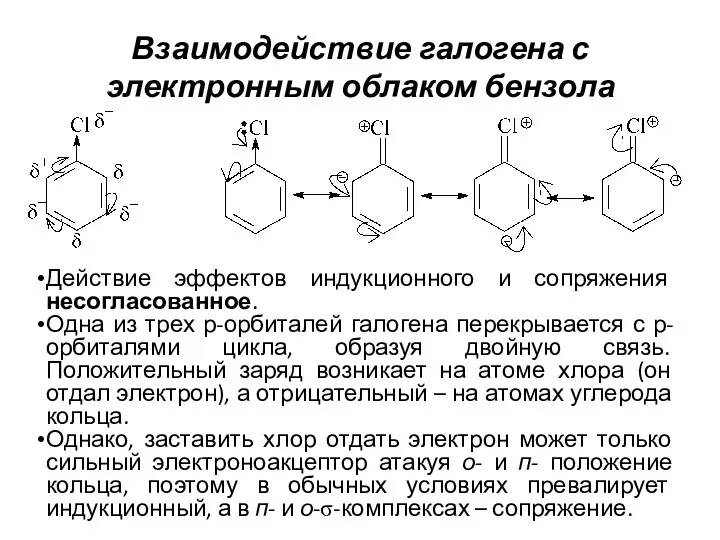
- 12. Взаимодействие галогена с электронным облаком бензола Действие эффектов индукционного и сопряжения несогласованное. Одна из трех р-орбиталей
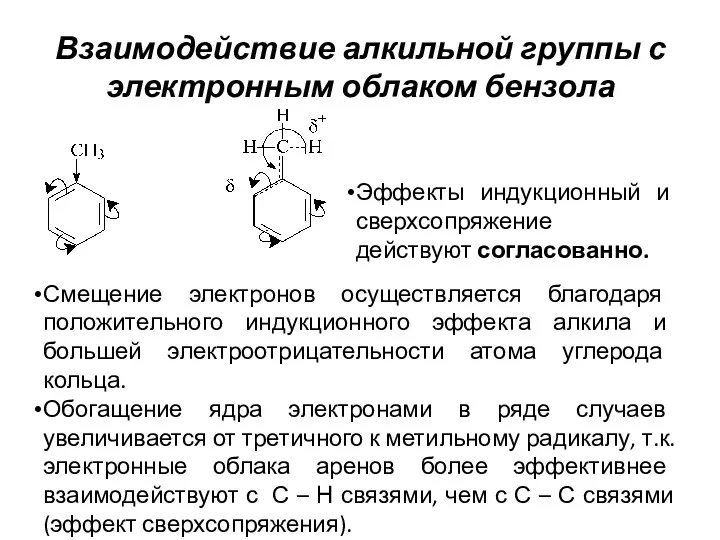
- 13. Взаимодействие алкильной группы с электронным облаком бензола Смещение электронов осуществляется благодаря положительного индукционного эффекта алкила и
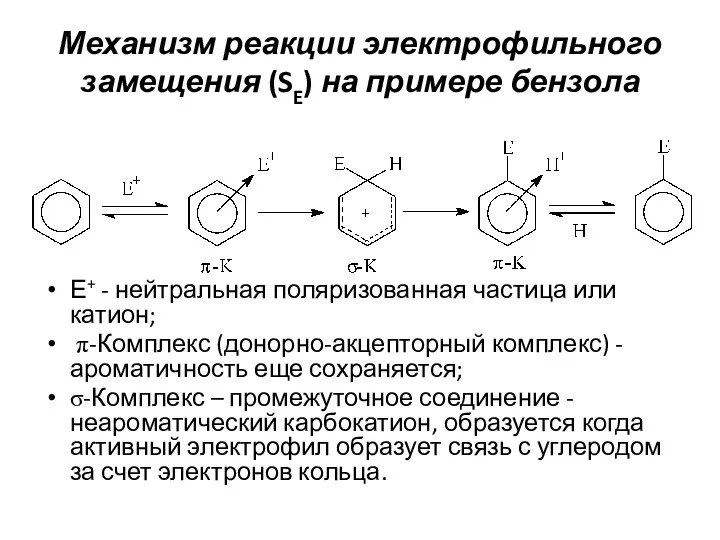
- 14. Механизм реакции электрофильного замещения (SE) на примере бензола Е+ - нейтральная поляризованная частица или катион; π-Комплекс
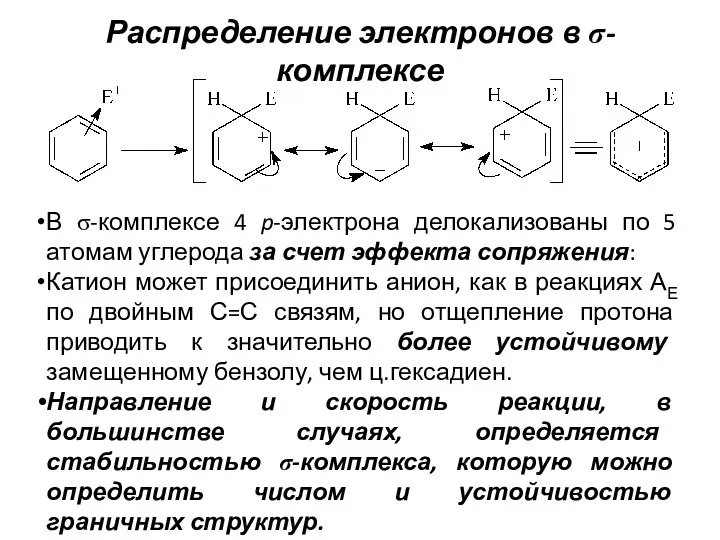
- 15. Распределение электронов в σ-комплексе В σ-комплексе 4 p-электрона делокализованы по 5 атомам углерода за счет эффекта
- 16. Направление и относительная реакционная способность замещенных бензолов -определяются уже имеющимися заместителями. Заместители первого рода: направляют электрофил
- 17. Заместители второго рода направляют электрофильный реагент в мета- положение; являются электроноакцепторами, уменьшают электронную плотность в ядре
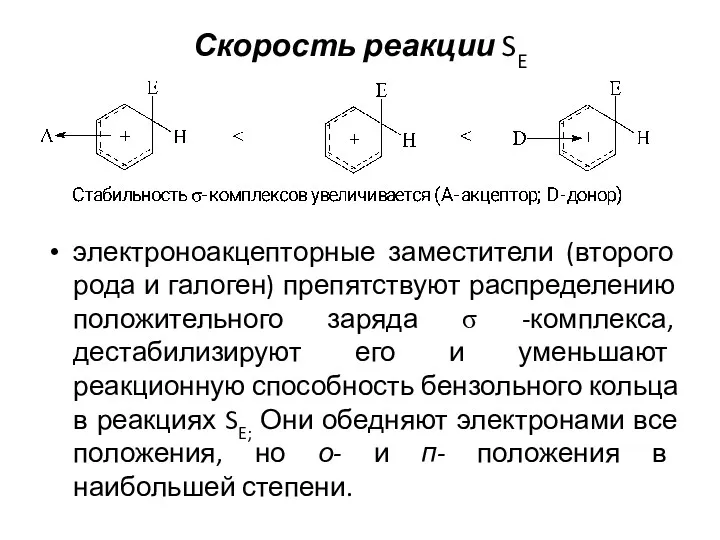
- 18. Скорость реакции SE - определяется устойчивостью σ-комплекса, которая зависит от равномерности распределения электронного облака по частице:
- 19. Скорость реакции SE электроноакцепторные заместители (второго рода и галоген) препятствуют распределению положительного заряда σ -комплекса, дестабилизируют
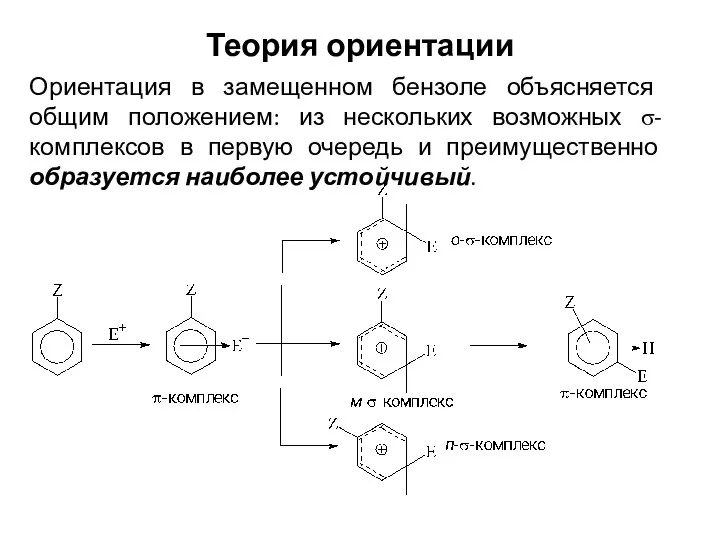
- 20. Теория ориентации Ориентация в замещенном бензоле объясняется общим положением: из нескольких возможных σ-комплексов в первую очередь
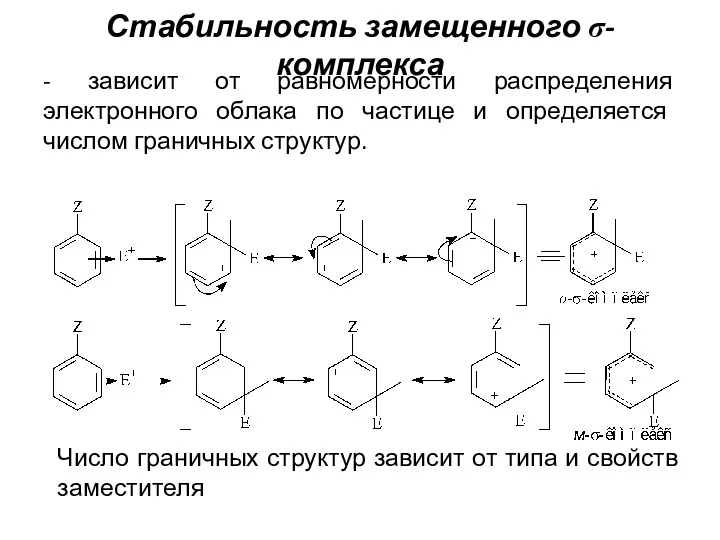
- 21. Стабильность замещенного σ-комплекса - зависит от равномерности распределения электронного облака по частице и определяется числом граничных
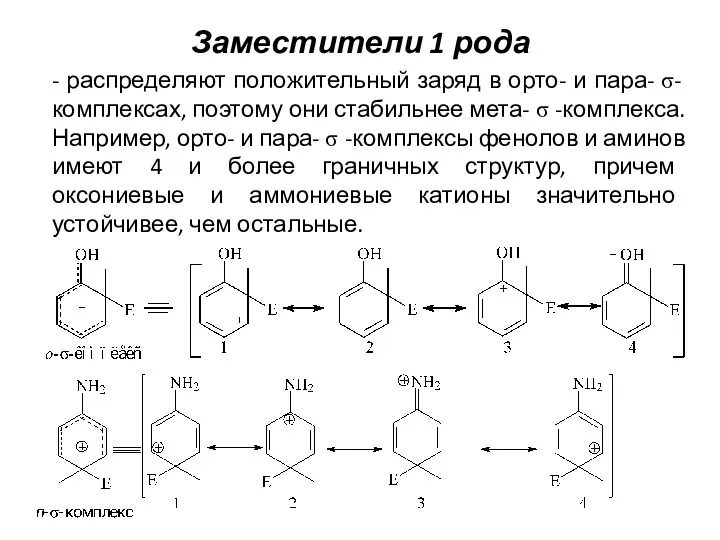
- 22. Заместители 1 рода - распределяют положительный заряд в орто- и пара- σ-комплексах, поэтому они стабильнее мета-
- 24. Скачать презентацию






 Атом – сложная частица
Атом – сложная частица Титриметрический метод анализа
Титриметрический метод анализа Химия и производство
Химия и производство Супрамолекулярний контроль для дослідження реакційної здатності та каталізу
Супрамолекулярний контроль для дослідження реакційної здатності та каталізу Тепловые эффекты химических реакций
Тепловые эффекты химических реакций Характеристика химических элементов и химических реакций
Характеристика химических элементов и химических реакций Арены. Бензол и его гомологи. Химия. 10 класс
Арены. Бензол и его гомологи. Химия. 10 класс Жиры. Мыла. СМС. 10 класс
Жиры. Мыла. СМС. 10 класс Растворы. Способы выражения концентраций. Сильные и слабые электролиты. Закон разведения Оствальда. Лекция 02-1
Растворы. Способы выражения концентраций. Сильные и слабые электролиты. Закон разведения Оствальда. Лекция 02-1 Якісні реакції на органічні сполуки
Якісні реакції на органічні сполуки Циклоалканы
Циклоалканы Электролиз водных растворов
Электролиз водных растворов Химические основы жизни
Химические основы жизни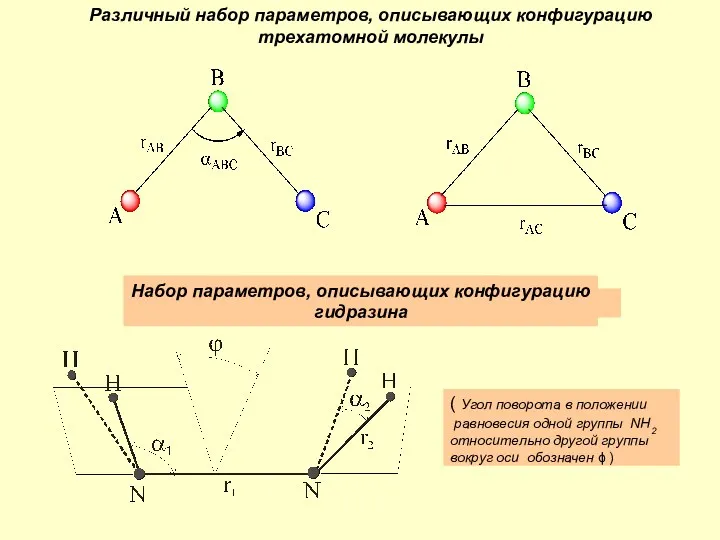 Различный набор параметров, описывающих конфигурацию трехатомной молекулы
Различный набор параметров, описывающих конфигурацию трехатомной молекулы Le trasformazioni fisiche della materia. Tema 3
Le trasformazioni fisiche della materia. Tema 3 Мир кристаллов. Изучение теоретического материала по теме Кристалл
Мир кристаллов. Изучение теоретического материала по теме Кристалл Неметаллы. Занятие 20
Неметаллы. Занятие 20 Карбонатна кислота. Солі карбонатної кислоти, їх поширення та застосування
Карбонатна кислота. Солі карбонатної кислоти, їх поширення та застосування Строение атома
Строение атома Р-элементы VI A группы. Свойства их соединений
Р-элементы VI A группы. Свойства их соединений Механізми та наслідки ураження людини небезпечними хімічними речовинами та бойовими отруйними речовинами
Механізми та наслідки ураження людини небезпечними хімічними речовинами та бойовими отруйними речовинами Решение задач. Органическая химия
Решение задач. Органическая химия Валентность и степень окисления. Правила определения степеней окисления элементов
Валентность и степень окисления. Правила определения степеней окисления элементов Природный и попутный нефтяной газ
Природный и попутный нефтяной газ История развития промышленности переработки полимеров
История развития промышленности переработки полимеров Сера и её соединения
Сера и её соединения Взрывчатые вещества, их история и применение
Взрывчатые вещества, их история и применение Бинарный урок. Минеральные удобрения. (9 класс)
Бинарный урок. Минеральные удобрения. (9 класс)