Слайд 2

Подумай и ответь
H2O HCl AlH3
Что общего у этих формул?
Какие различия?
От чего зависит количество атомов водорода в каждом веществе?
Слайд 3
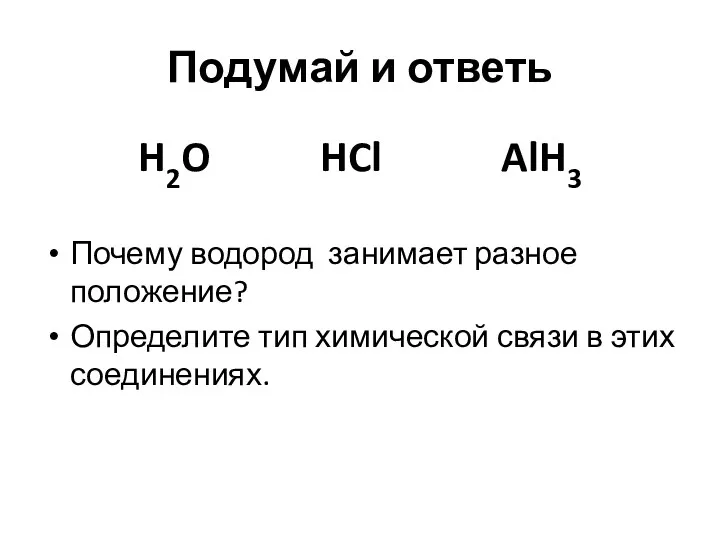
Подумай и ответь
H2O HCl AlH3
Почему водород занимает разное положение?
Определите тип химической
связи в этих соединениях.
Слайд 4

Правила определения валентности
1. Валентность водорода принимают за I (единицу).
2. Кислород
в своих соединениях всегда проявляет валентность II.
3. Высшая валентность элемента равна номеру группы.
4. Низшая валентность равна разности между числом 8 (количество групп в таблице) и номером группы, в которой находится данный элемент, т.е. 8 - Nгруппы.
5. У металлов, находящихся в «А» подгруппах, валентность равна номеру группы.
6. У неметаллов в основном проявляются две валентности: высшая и низшая. Например: сера имеет высшую валентность VI и низшую (8 – 6), равную II; фосфор проявляет валентности V и III.
7. Валентность может быть постоянной или переменной.
Слайд 5

Слайд 6

Степень окисления – это условный заряд, возникающий на атоме в
результате сдвига электронов от менее электроотрицательного к более электроотрицательному атому. Она может быть положительной и отрицательной.
H+2O-2 H + Cl - Al +3 H -3
Слайд 7

Правила определения степени окисления
1. Водород обычно проявляет степень окисления (СО) +1
(исключение, соединения с металлами (гидриды) – у водорода СО равна (-1) Me+nHn-1
2. Кислород обычно проявляет СО -2 (исключения: О+2F2, H2O2-1 – перекись водорода)
3. Металлы проявляют только +n положительную СО
4. Фтор проявляет всегда СО равную -1 (F-1)
5. Для элементов главных подгрупп:
Высшая СО (+) = номеру группы Nгруппы
Низшая СО (-) = Nгруппы–8
Слайд 8

Правила определения степени окисления
6. Степень окисления свободных атомов и атомов в
молекулах простых веществ равна нулю - Na0, P40, O20
7. В сложном веществе алгебраическая сумма СО всех атомов с учётом их индексов равна нулю = 0, а в сложном ионе его заряду.
Слайд 9
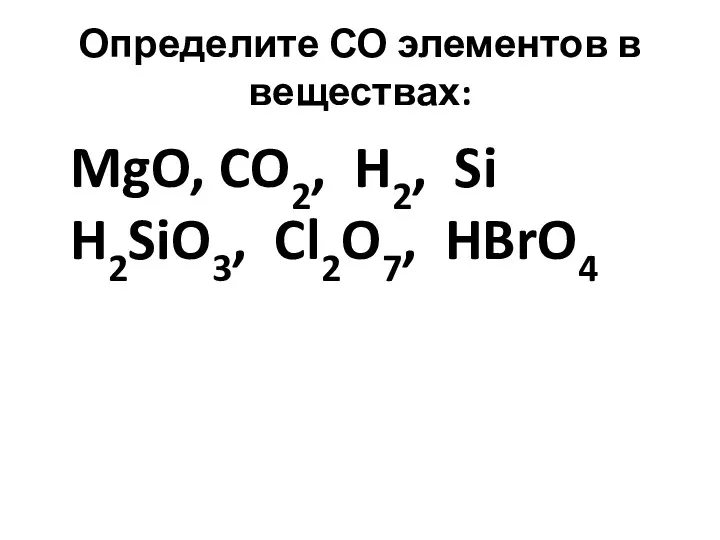
Определите СО элементов в веществах:
MgO, CO2, H2, Si H2SiO3, Cl2O7,
HBrO4
Слайд 10

Выполните самостоятельно:
1. Расставьте степени окисления элементов в каждом веществе.
CaO H2S SO2
Cu2O NaCl
2. Какая формула правильна (запишите):
AlCl3 AlCl2 AlCl
3. Вам дано вещество, формула которого H2SO4.
Задание. Найдите степени окисления всех элементов в сложном веществе. Неизвестную степень окисления элемента возьмите за Х.
Составьте уравнение с одним неизвестным, приравняв сумму степеней окисления к 0.
Слайд 11

Алгоритм оценки:
Если выполнены правильно все 3 задания – отметка «5»,
Если выполнены
правильно 2 задания – отметка «4»,
Если выполнено 1 задание – отметка «3».










 Предмет и объекты исследования коллоидной химии. Лекция 01
Предмет и объекты исследования коллоидной химии. Лекция 01 Промышленное производство аммиака
Промышленное производство аммиака Rates of reaction
Rates of reaction Алюминий и его сплавы
Алюминий и его сплавы Алкины. Самостоятельная работа
Алкины. Самостоятельная работа Тепловой эффект химической реакции. Топливо. Водород. 8 класс
Тепловой эффект химической реакции. Топливо. Водород. 8 класс Химические свойства основных классов неорганических соединений
Химические свойства основных классов неорганических соединений Бензен. Номенклатура. Хімічні властивості
Бензен. Номенклатура. Хімічні властивості Химические уравнения
Химические уравнения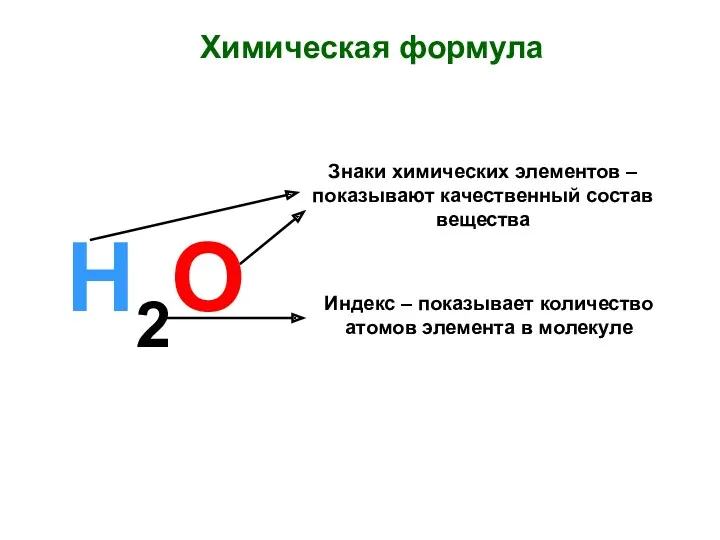 Химическая формула. Знаки химических элементов
Химическая формула. Знаки химических элементов История открытия периодической системы химических элементов Д.И. Менделеева
История открытия периодической системы химических элементов Д.И. Менделеева An introduction to the chemistry of alkenes
An introduction to the chemistry of alkenes Химия. Отличие химических свойств от физических
Химия. Отличие химических свойств от физических Ертінділер. Ерітінді концентрациясын білдіру тәсілдері
Ертінділер. Ерітінді концентрациясын білдіру тәсілдері Хлороводород..Соляная кислота
Хлороводород..Соляная кислота Закон сохранения массы веществ
Закон сохранения массы веществ Дисперсные системы
Дисперсные системы Производство чугуна и стали
Производство чугуна и стали Характеристика строения и свойств химических элементов
Характеристика строения и свойств химических элементов Лигандообменные равновесия и процессы. Строение комплексных соединений
Лигандообменные равновесия и процессы. Строение комплексных соединений Физические явления – основа разделения смесей в химии (урок химии в 8 классе)
Физические явления – основа разделения смесей в химии (урок химии в 8 классе) Хлороводород. Соляная кислота
Хлороводород. Соляная кислота Окисление и восстановление
Окисление и восстановление Классификация химических реакций
Классификация химических реакций Основания. Состав, классификация, свойства, получение
Основания. Состав, классификация, свойства, получение Водород, получение, свойства и применение
Водород, получение, свойства и применение Швидкість та механізм хімічних реакцій. Каталіз. Хімічна рівновага
Швидкість та механізм хімічних реакцій. Каталіз. Хімічна рівновага Оборотні і необоротні реакції. Хімічна рівновага
Оборотні і необоротні реакції. Хімічна рівновага