Слайд 2
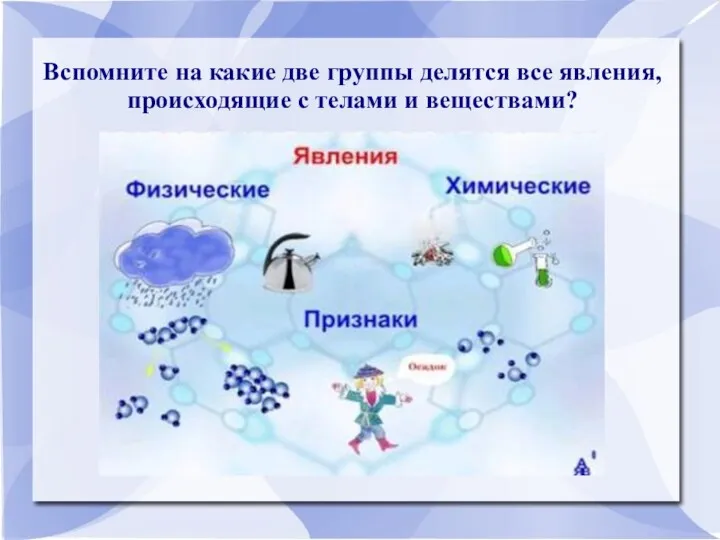
Вспомните на какие две группы делятся все явления, происходящие с телами
и веществами?
Слайд 3

Какие признаки химических реакций вы знаете?
Слайд 4

Какие условия должны выполняться,чтобы произошла химическая реакция?
Необходимо,чтобы реагирующие вещества соприкоснулись.
Нагревание.
Электрический ток
или свет.
Слайд 5

“Все изменения,которые случаются в действительности,находятся в таком состоянии,что сколь от одного
тела отнимается,столько прибавляется к другому,так что где убудет немного материи,то умножится в другом месте”
М.В.Ломоносов(1756г)
Слайд 6

Современная формулировка закона сохранения массы веществ:
Масса веществ,вступивших в химическую реакцию,равна массе
веществ,получившихся в результате её.
Слайд 7

На основании закона сохранения массы веществ составляют уравнения химических реакций
Слайд 8

Запишите уравнение:
железо+сера=сульфид железа(II)
Fe+S=FeS
Слайд 9

Алгоритм расстановки коэффициентов в уравнениях химических реакций
Подсчитать количество атомов каждого элемента
в правой и левой части уравнения химической реакции.
Определить, у какого элемента количество атомов меняется, найти НОК.
Разделить НОК на индексы – получить коэффициенты. Поставить их перед формулами.
Пересчитать количество атомов, при необходимости действие повторить.
Последним проверить количество атомов кислорода.
Слайд 10

Расставьте коэффициенты в уравнениях химических реакций:
1) KCLO3→KCL+O2
2) Na+Cl2→NaCl
3) KNO3→KNО2+O2
4) H2O+SO3→H2SO4
5) Al+S→Al2S3
6) H2O2→H2O+O2
7) Rb2O+H2O→RbOH
8) Ba+O2→BaO
Слайд 11

Домашнее задание:
параграф 27 стр139-145,упражнение1; расставьте коэффициенты в уравнениях реакций:
P + Cl2
→ PCl5
Na + S → Na2S
HCl + Mg → MgCl2 + H2
N2 + H2 → NH3
H2O → H2 + O2










 Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Этот многоликий цинк
Этот многоликий цинк Реологические свойства полимеров
Реологические свойства полимеров Подготовка к ГИА. А14. Определение характера среды раствора кислот и щелочей с помощью индикаторов. Реакции на ионы в растворе
Подготовка к ГИА. А14. Определение характера среды раствора кислот и щелочей с помощью индикаторов. Реакции на ионы в растворе Тепловий ефект хімічних реакцій. Екзотермічні і ендотермічні реакції. Термохімічні рівняння
Тепловий ефект хімічних реакцій. Екзотермічні і ендотермічні реакції. Термохімічні рівняння Теория сильных электролитов. Закон действующих масс и его применение к гетерогенным равновесиям
Теория сильных электролитов. Закон действующих масс и его применение к гетерогенным равновесиям Неметаллы
Неметаллы Классификация неорганических веществ
Классификация неорганических веществ Геохимические классификации элементов
Геохимические классификации элементов Синтез и химические модификации индиго
Синтез и химические модификации индиго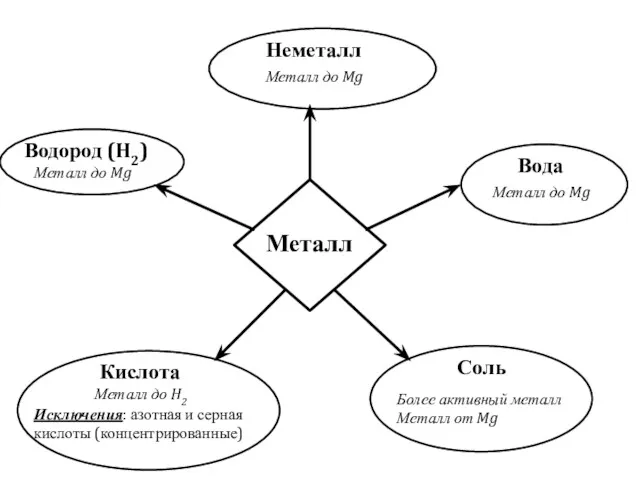 Химические свойства металлов
Химические свойства металлов Тайна мыльного пузыря
Тайна мыльного пузыря Неметали. Фізичні та хімічні властивості. Явище адсорбції. Сполуки неметалічних елементів з Гідрогеном
Неметали. Фізичні та хімічні властивості. Явище адсорбції. Сполуки неметалічних елементів з Гідрогеном Электроотрицательность химических элементов
Электроотрицательность химических элементов Соли как производные кислот и оснований
Соли как производные кислот и оснований Твердое состояние вещества. Плавление
Твердое состояние вещества. Плавление Химия в искусстве
Химия в искусстве Щелочи
Щелочи Основания
Основания Генетическая связь между классами веществ
Генетическая связь между классами веществ Обмен простых белков. Дезаминирование и трансаминирование аминокислот
Обмен простых белков. Дезаминирование и трансаминирование аминокислот Свойства, состав и применение пластмасс
Свойства, состав и применение пластмасс Международный Год периодической таблицы химических элементов
Международный Год периодической таблицы химических элементов Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы
Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы Carbohydrates and their metabolism. Digestion of carbohydrates
Carbohydrates and their metabolism. Digestion of carbohydrates Физические и химические явления
Физические и химические явления Сложные эфиры
Сложные эфиры Водород. Распространенность в природе
Водород. Распространенность в природе