Содержание
- 2. Цель и задачи урока. Цель урока: выяснить почему соли являются производными кислот и оснований. Задачи урока:
- 3. Вопросы 4. Что такое кислоты? 1. Какие классы веществ вы знаете? 2. Что такое оксиды? 3.
- 4. NO HNO NaOH HNO 2 3 К какому классу соединений относятся вещества, дать им названия
- 5. CO 2 2 H CO Mg(OH) 2 3 H SO 2 3 H SO 2 4
- 6. ТЕСТ 1. Определите ряд формул состоящих только из: кислотных оксидов ( I вариант) основных оксидов: (II
- 7. ТЕСТ 2. Выберите из списка веществ формулы: только кислот (I вариант), формулы только оснований (II вариант):
- 8. ТЕСТ 3. Выберите формулу оксида серы (IV) – I вариант Выберите формулу оксида углерода (II) –
- 9. ТЕСТ 4. * Выберите формулу серной кислоты – I вариант * Выберите формулу сернистой кислоты –
- 10. ТЕСТ 5. * Выберите формулу гидроксида калия – I вариант * Выберите формулу гидроксида кальция -
- 11. ТЕСТ 6. * Выберите формулы растворимого в воде основания – I вариант * Выберите формулы нерастворимого
- 12. ТЕСТ 7. * Выберите формулы, в которых лакмус меняет свой цвет на красный – I вариант
- 13. Ответы к тесту. I вариант II вариант 1. б 1. в 2. б 2. г 3.
- 14. Критерии оценивая. Оценка «5» - одна ошибка Оценка «4» - две ошибки Оценка «3» - три
- 15. Выберите формулы веществ, которые вам не известны. Na2SO4 HCI CO2 K2S H2SO4 AI2O3 ВаCl2 KOH СОЛИ
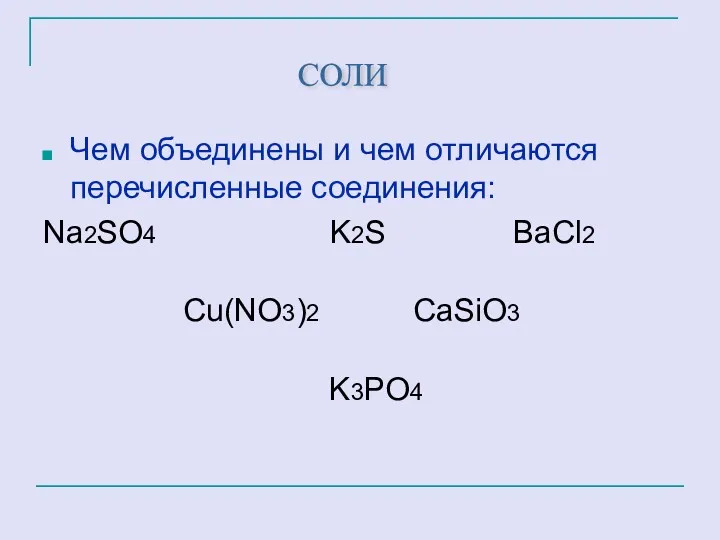
- 16. Чем объединены и чем отличаются перечисленные соединения: Na2SO4 K2S ВаCl2 Cu(NO3)2 CaSiO3 K3PO4 СОЛИ
- 17. Cоли – это сложные вещества, состоящие из атомов металла и кислотного остатка. СОЛИ
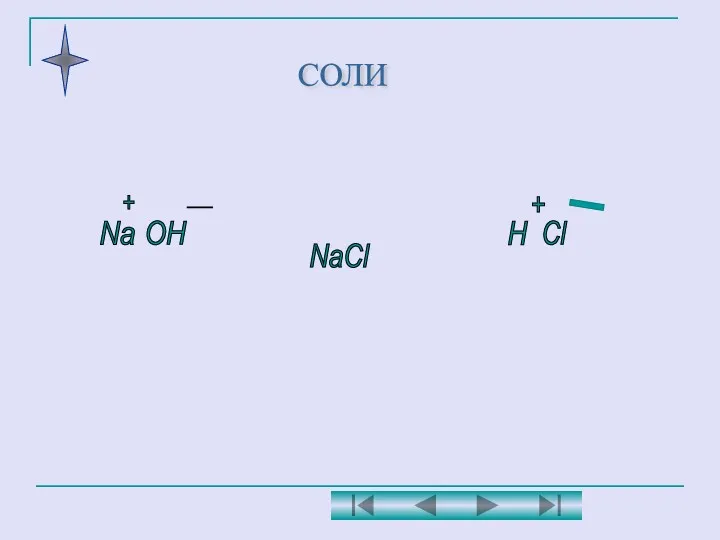
- 18. СОЛИ Na OH H Cl NaCl + - + _
- 19. Соли С уверенностью можно сказать, что, по крайней мере, одно химическое соединение в довольно чистом виде
- 20. Соли Гипс – кристаллогидрат сульфата кальция СаSO4 * 2H2O
- 21. Соли Из мрамора (СаСО3) сделан дворец в Индии Тадж- Махал
- 22. Соли Кристаллогидрат сульфата меди (II) СuSO4* 5H2O Безводный сульфат меди(II)
- 23. Соли * Кристаллогидрат железа или железный купорос FeSO4* 7H2O * Сульфат магния –горькая английская соль MgSO4
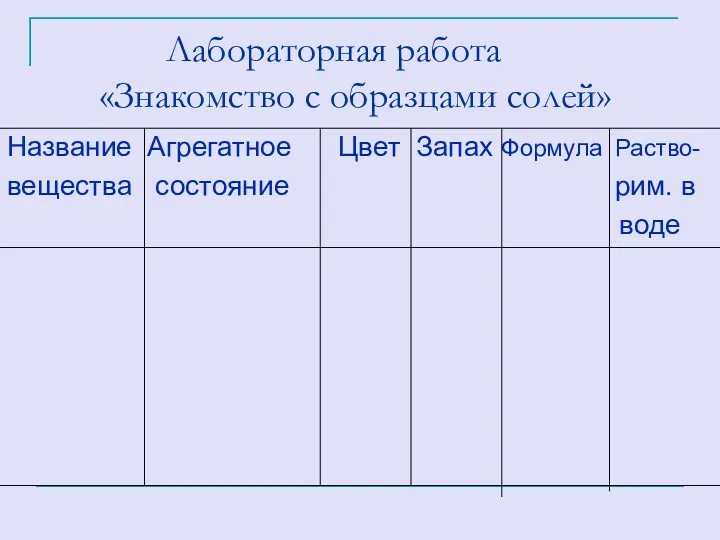
- 24. Лабораторная работа «Знакомство с образцами солей» Название Агрегатное Цвет Запах Формула Раство- вещества состояние рим. в
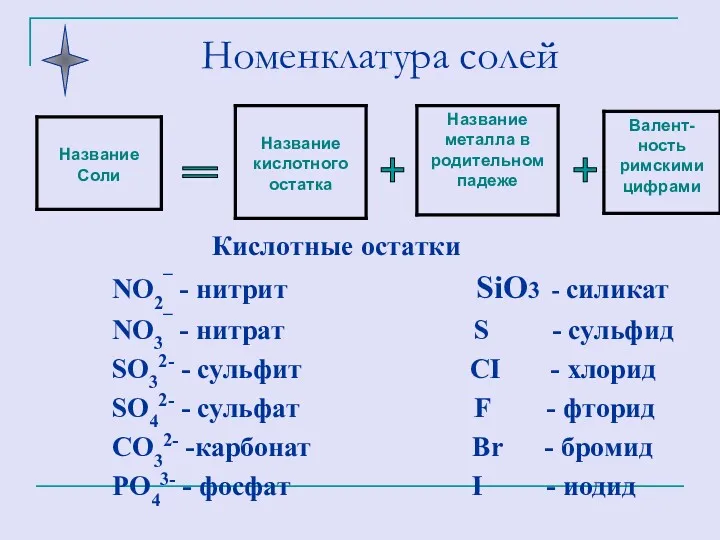
- 25. Номенклатура солей + + =
- 26. Составить формулу сульфата алюминия: Составьте формулы: сульфата натрия, сульфата кальция, сульфата железа(III). Al 2 + SO
- 27. Классификация 1. По составу кислотного остатка основные NaOHSO4 СОЛИ средние кислые Na 2SO4 K3PO4 NaHSO4 K2HPO4
- 28. Классификация 2. По растворимости растворимые нерастворимые в воде в воде Na2SO4 AgCI KNO3 BaSO4
- 29. ЗАКРЕПЛЕНИЕ 1. Что такое соли? 2. Дать названия веществам: Ca(NO3)2, K2SO3, Li2CO3, CuSO4. Определить растворимость этих
- 31. Скачать презентацию
























 Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Соединения щелочных металлов
Соединения щелочных металлов Об изучении окислительно-восстановительных реакций в школьном курсе химии. Степени окисления атомов и формулы веществ
Об изучении окислительно-восстановительных реакций в школьном курсе химии. Степени окисления атомов и формулы веществ Відносна молекулярна маса речовини, її обчислення за хімічною формулою
Відносна молекулярна маса речовини, її обчислення за хімічною формулою Алканы
Алканы Химические свойства основных классов неорганических веществ
Химические свойства основных классов неорганических веществ Дистиляттағы цианидтер, алифаттық қатардағы галоген туындылары, хлороформ, хлоралгидрат, төртхлорлы көміртек
Дистиляттағы цианидтер, алифаттық қатардағы галоген туындылары, хлороформ, хлоралгидрат, төртхлорлы көміртек Углеводородное сырье: способы переработки
Углеводородное сырье: способы переработки Предельные углеводороды
Предельные углеводороды Комплесные соединения
Комплесные соединения Мұнай. Мұнайдың шығу тарихы
Мұнай. Мұнайдың шығу тарихы Лекция 1. Периодический закон и периодическая система химических элементов. Индустрия красоты
Лекция 1. Периодический закон и периодическая система химических элементов. Индустрия красоты Салыстырмалы тығыздығы мен элементтердің массалық үлестері бойынша газ күйіндегі заттардың молекулалық формулаларын табу
Салыстырмалы тығыздығы мен элементтердің массалық үлестері бойынша газ күйіндегі заттардың молекулалық формулаларын табу Алкалоидтар түсінігі. Никотин, кофеин,морфин, хинин туралы түсініктер
Алкалоидтар түсінігі. Никотин, кофеин,морфин, хинин туралы түсініктер Неметаллические материалы, используемые в машино- и приборостроении
Неметаллические материалы, используемые в машино- и приборостроении Спирти. 3агальна характеристика спиртів
Спирти. 3агальна характеристика спиртів Алюминий и его соединения
Алюминий и его соединения Метаболизм нуклеиновых кислот
Метаболизм нуклеиновых кислот Азотистые гетероциклические соединения
Азотистые гетероциклические соединения Формы минералов и их агрегатов
Формы минералов и их агрегатов Химические свойства металлов
Химические свойства металлов Що ховається за цифрами? Харчові домішки
Що ховається за цифрами? Харчові домішки Адсорбция-фазалар бөлу беттерінде жүретін бір компоненттің екінші компонентке сіңуі
Адсорбция-фазалар бөлу беттерінде жүретін бір компоненттің екінші компонентке сіңуі Угарный газ
Угарный газ Контрольная работа по дисциплине Физическая химия. Раздел: Электрохимия
Контрольная работа по дисциплине Физическая химия. Раздел: Электрохимия Адсорбция. Разделение однородных и неоднородных смесей
Адсорбция. Разделение однородных и неоднородных смесей Ферум та його сполуки
Ферум та його сполуки Аминокислоты. Белки
Аминокислоты. Белки