Содержание
- 2. Ферум як хімічний елемент d-елемент 4 періоду VIIIB підгрупи; відновник Ступінь окиснення: 0;+2; +3; іноді +6
- 3. Поширення в природі Переважно у вигляді сполук – 2-ий за поширенням метал в природі (4-е місце
- 4. Фізичні властивості заліза Метал сірого кольору з металічним блиском; добре проводить електричний струм і теплоту; пластичний,
- 5. Хімічні властивості заліза як простої речовини 1) З киснем (на вологому повітрі): 4Fe + 6H2O +
- 6. Хімічні властивості заліза як простої речовини з кислотами-окисниками (концентрованими сульфатною та нітратною кислотами) Ферум окиснюється до
- 7. Хімічні властивості сполук Феруму FeO↓ и Fe(OH)2 ↓ – переважно основні сполуки Fe2O3 ↓ и Fe(OH)3
- 8. Ферум (ІІ) оксид та гідроксид Оксид і гідроксид Феруму(ІІ) мають переважно основні властивості: 5) Гідроксид Феруму
- 9. Ферум (ІІІ) оксид та гідроксид Ферум(ІІІ) гідроксид утворюється внаслідок дії лугів на розчини солей Феруму(ІІІ): Гідроксид
- 10. Якісні реакції на солі Феруму (ІІ) та Феруму (ІІІ): Реактивом на йони Феруму(ІІ) є червона кров’яна
- 11. Застосування заліза та його сплавів СПЛАВИ Fe з C Чавун Сталь Вміст C до 4,5% по
- 13. Скачать презентацию










 Характеристика АХОВ и их поражающих факторов
Характеристика АХОВ и их поражающих факторов БАЗ синтездеудің химиялық технологиясы Синтетикалық түсінік
БАЗ синтездеудің химиялық технологиясы Синтетикалық түсінік Кислоты НСL, H2 O, H2 CO3
Кислоты НСL, H2 O, H2 CO3 Марганец
Марганец Люминесцентный анализ
Люминесцентный анализ Введение в неорганическую химию. Классификация неорганических соединений
Введение в неорганическую химию. Классификация неорганических соединений Производство серной кислоты контактным способом
Производство серной кислоты контактным способом Готовимся к экзамену по химии. 9 класс
Готовимся к экзамену по химии. 9 класс Химические свойства карбоновых кислот
Химические свойства карбоновых кислот Практическая работа №1. Приготовление раствора с определенной массовой долей соли
Практическая работа №1. Приготовление раствора с определенной массовой долей соли Циклоалканы
Циклоалканы Наноалотропи карбону: класифікація, одержання та застосування
Наноалотропи карбону: класифікація, одержання та застосування Строение и функции биополимеров
Строение и функции биополимеров Ауыр түсті металдар
Ауыр түсті металдар Методы комплексонометрии. Количественный анализ
Методы комплексонометрии. Количественный анализ Многоядерные ароматические углеводороды
Многоядерные ароматические углеводороды Физико-химия дисперсных систем в функционировании живых систем
Физико-химия дисперсных систем в функционировании живых систем Лабораторная работа Исследование состава молока
Лабораторная работа Исследование состава молока Типы заданий. ЕГЭ №32
Типы заданий. ЕГЭ №32 Растворы
Растворы Белоктар. Биохимиясы
Белоктар. Биохимиясы Природный и попутный нефтяной газы
Природный и попутный нефтяной газы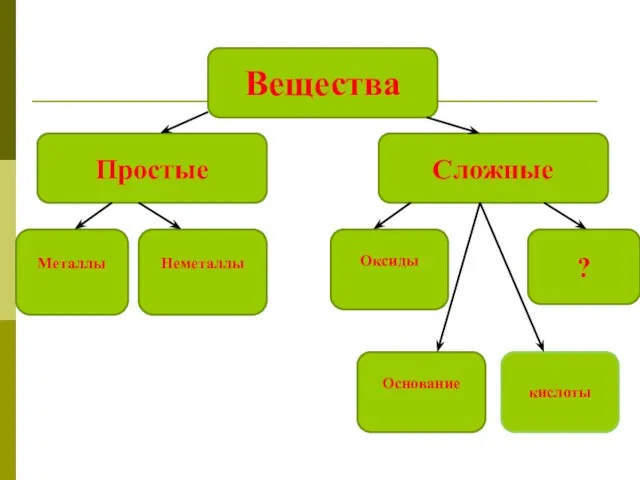 Соли, как производные кислот и оснований
Соли, как производные кислот и оснований История развития и предмет исследования супрамолекулярной химии. Классификация супрамолекулярных соединений
История развития и предмет исследования супрамолекулярной химии. Классификация супрамолекулярных соединений Поверхностные явления на границе раздела фаз. Хроматография, применение в медицинской практике
Поверхностные явления на границе раздела фаз. Хроматография, применение в медицинской практике Лекарственные средства, относящиеся к производным пиридина : производные никотиновой и изоникотиновой кислоты
Лекарственные средства, относящиеся к производным пиридина : производные никотиновой и изоникотиновой кислоты Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы
Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы Основные химические понятия
Основные химические понятия