Содержание
- 2. ЦЕЛЬ УРОКА: Изучить химические свойства карбоновых кислот.
- 3. Сегодня вы : Познакомитесь с химическими свойствами карбоновых кислот; Узнаете, чем органические кислоты похожи на неорганические,
- 4. 1) - ОН Правильный ответ: 2) Какая функциональная группа называется карбоксильной?
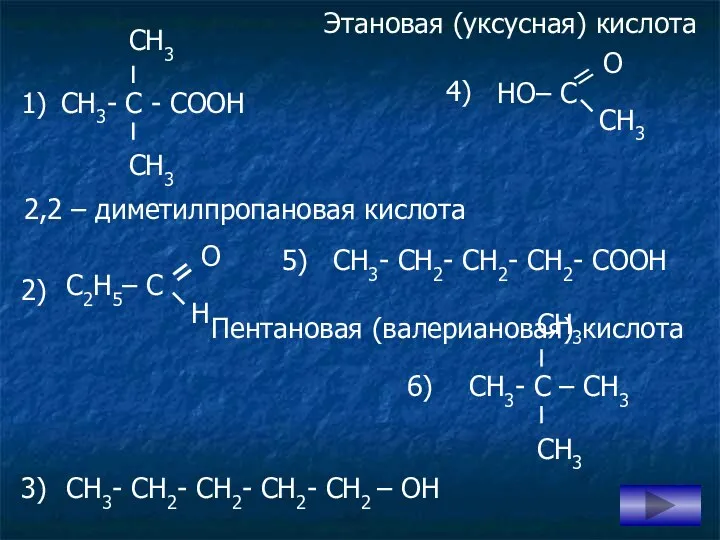
- 5. СН3- СН2- СН2- СН2- СООН 1) 4) 2) 5) 6) СН3- СН2- СН2- СН2- СН2 –
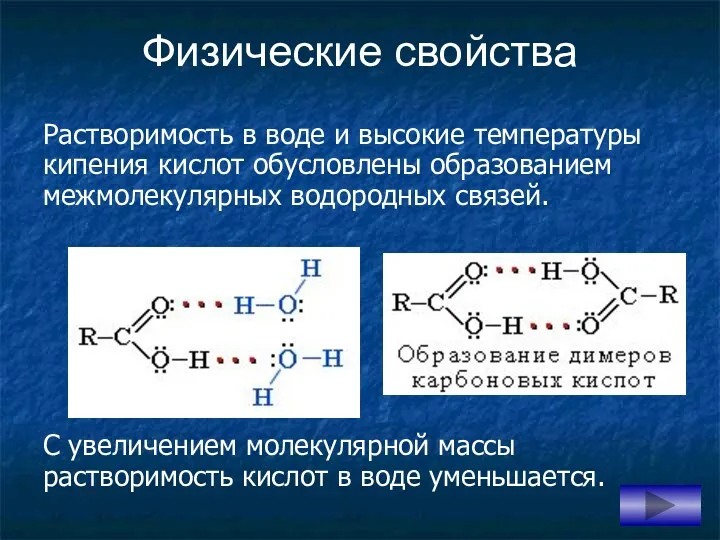
- 6. Растворимость в воде и высокие температуры кипения кислот обусловлены образованием межмолекулярных водородных связей. С увеличением молекулярной
- 7. Йорданс Якоб «Пир Клеопатры» 1653 “Она … опустила жемчужину в уксус… Когда от нее не осталось
- 8. Химические свойства неорганических кислот. + - 1.Диссоциация: HCl = H + Cl 2.Взаимодействие с металлами: 2
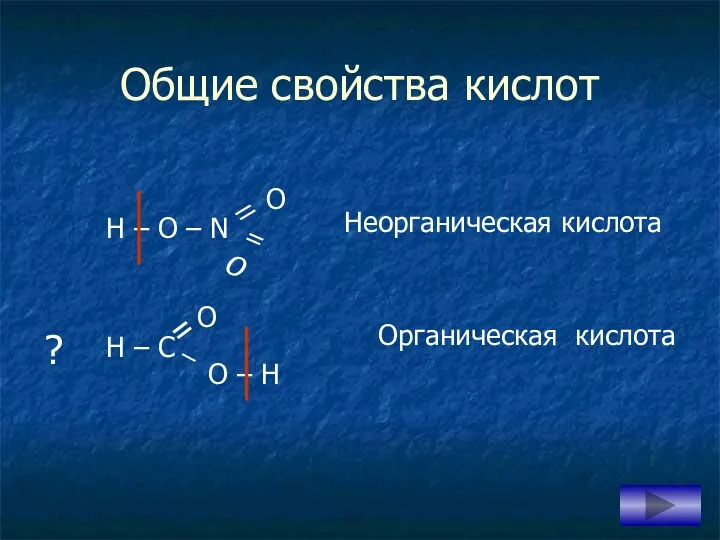
- 10. Общие свойства кислот H – O – N O – H ? Неорганическая кислота Органическая кислота
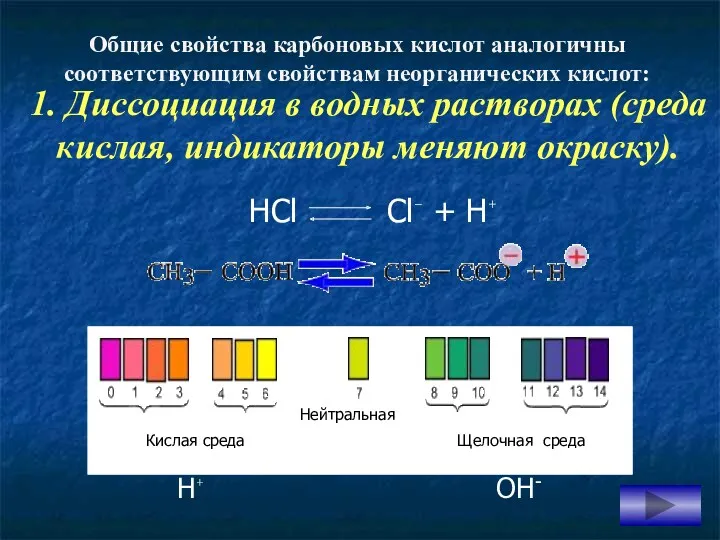
- 11. НСl Сl⁻ + Н⁺ 1. Диссоциация в водных растворах (среда кислая, индикаторы меняют окраску). Н⁺ ОН-
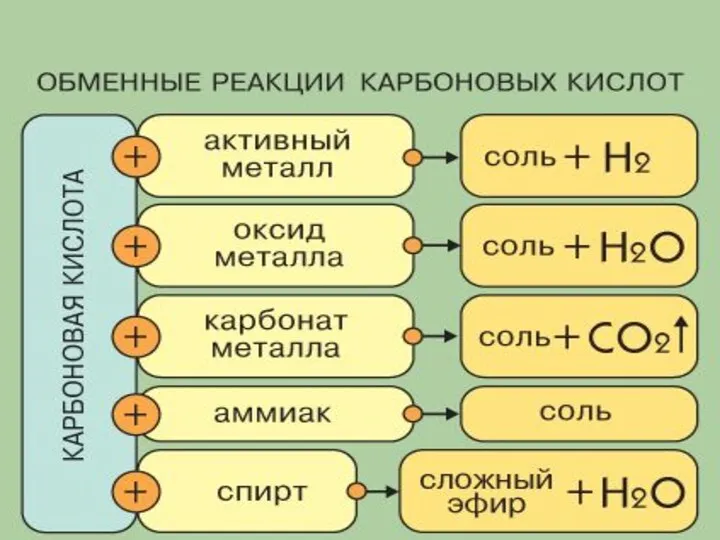
- 12. Карбоновые кислоты вступают в реакцию замещения с металлами, стоящими в ряду напряжений до водорода. 2НСООН +
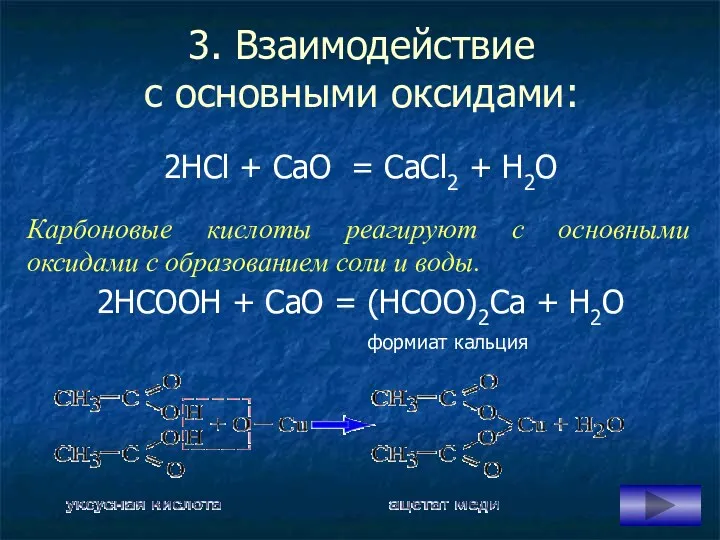
- 13. 3. Взаимодействие с основными оксидами: 2НСl + СаО = СаCl2 + H2О 2НСООН + СаО =
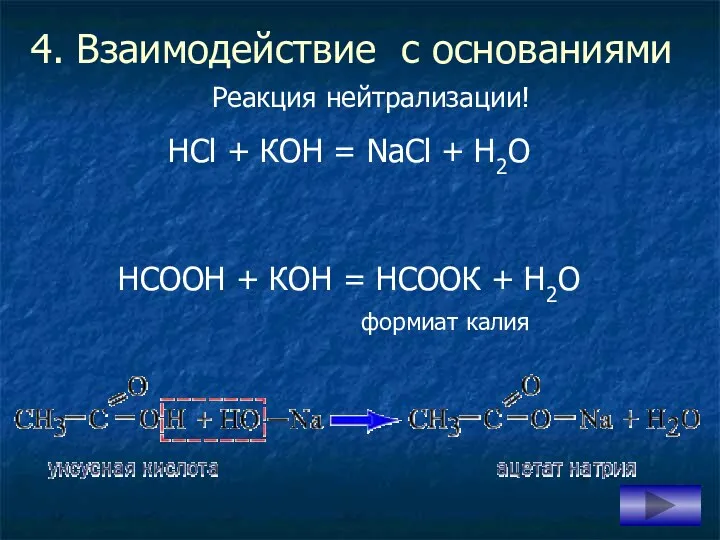
- 14. 4. Взаимодействие с основаниями НСl + КОH = NаCl + H2О НСООН + КОН = НСООК
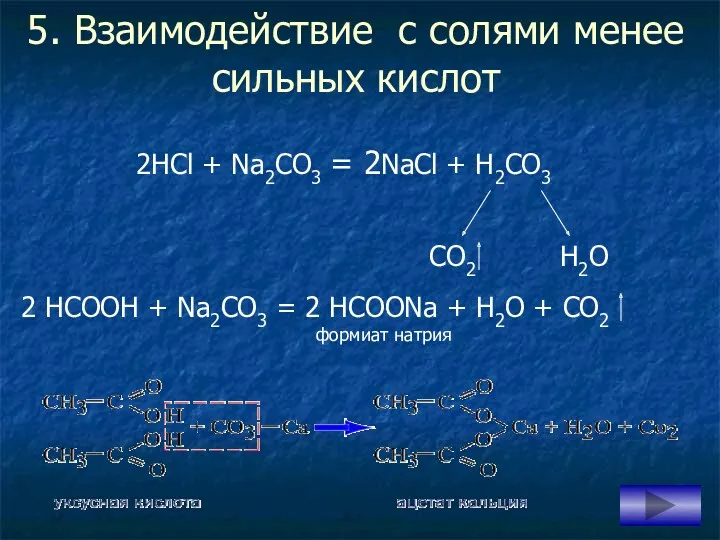
- 15. 5. Взаимодействие с солями менее сильных кислот 2НСl + Na2СО3 = 2NаCl + H2CО3 формиат натрия
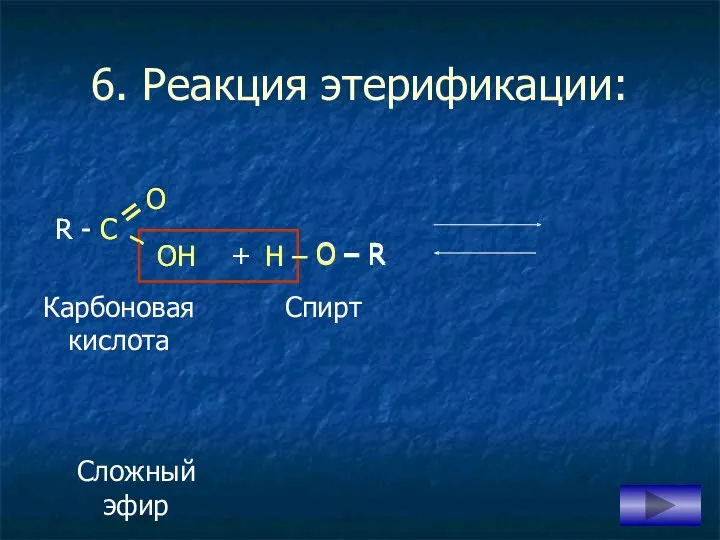
- 16. 6. Реакция этерификации: – OH O – R + H – O – R OH H
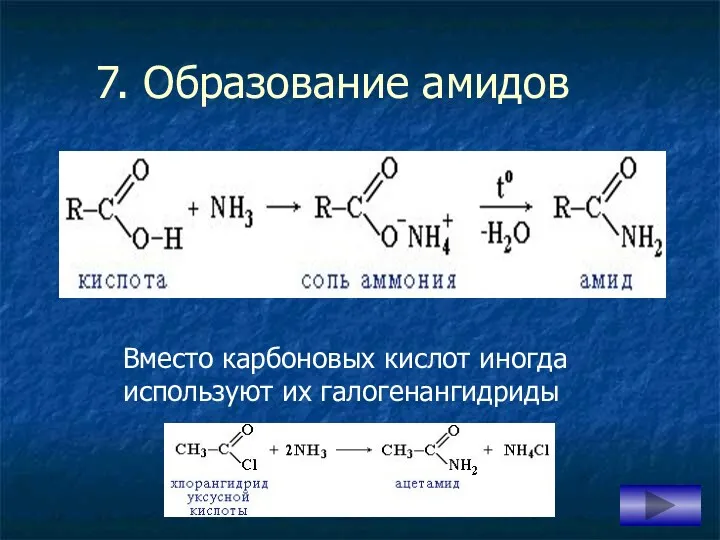
- 17. 7. Образование амидов Вместо карбоновых кислот иногда используют их галогенангидриды
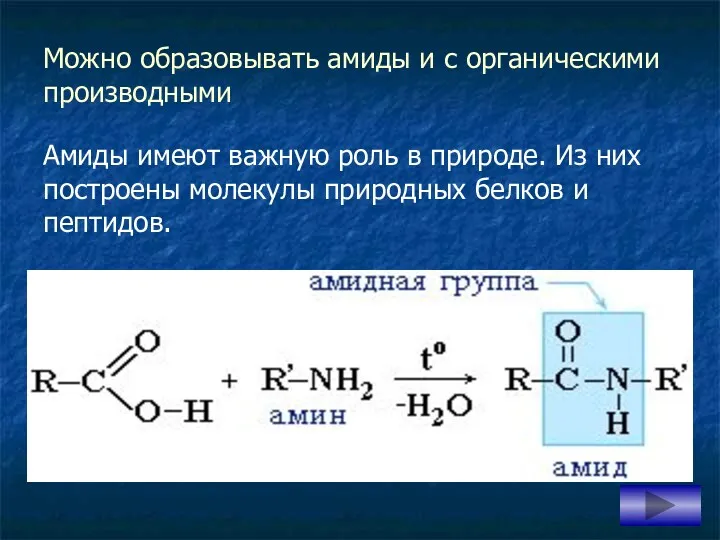
- 18. Можно образовывать амиды и с органическими производными Амиды имеют важную роль в природе. Из них построены
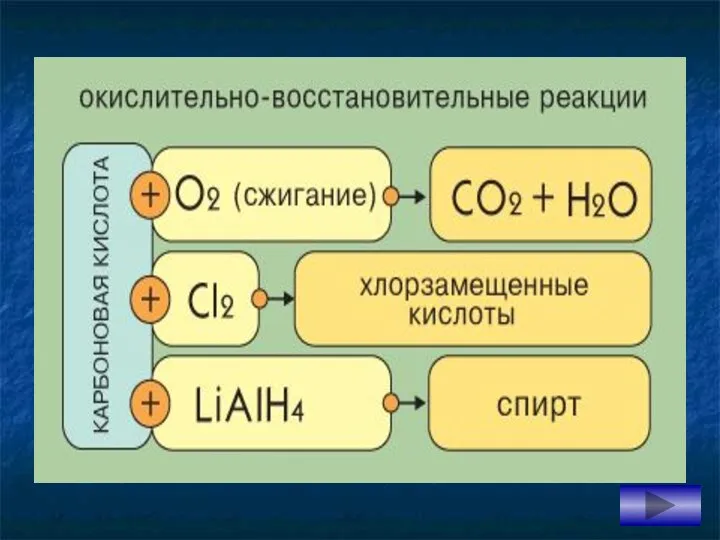
- 20. 8. Галогенирование Cl – Cl + CH3COOH → Cl CH2COOH + HCl монохлоруксусная кислота хлор
- 21. Выполнить задания: Учебник: 1) Упр. 17 (а,б) – стр. 118. 2) Задача 1 (с. 118).
- 22. Домашнее задание § 28 (прочитать), табл. 11 (с. 111-112)-заучить, упр. 18, задача 2 (с.118).
- 24. Скачать презентацию








 Арени. Бензен: молекулярна і структурна формули, фізичні властивості
Арени. Бензен: молекулярна і структурна формули, фізичні властивості Подготовка к ГИА. В2. Первоначальные сведения об органических веществах. Биологически важные вещества: белки, жиры, углеводы
Подготовка к ГИА. В2. Первоначальные сведения об органических веществах. Биологически важные вещества: белки, жиры, углеводы Термический анализ. Прибор синхронного термического анализа
Термический анализ. Прибор синхронного термического анализа Аналитическая химия
Аналитическая химия Методы анализа качества воды
Методы анализа качества воды Основные классы неорганических соединений
Основные классы неорганических соединений Химические свойства основных неорганических соединений в свете ЭД и ОВР. 9 класс
Химические свойства основных неорганических соединений в свете ЭД и ОВР. 9 класс Бериллий. Строение элемента. Физические и химические свойства. Способы получения. Применение. Интересные факты. Опыты
Бериллий. Строение элемента. Физические и химические свойства. Способы получения. Применение. Интересные факты. Опыты Спирты & Фенолы
Спирты & Фенолы Полімерні композиційні матеріали
Полімерні композиційні матеріали Формирование ключевых компетенций на уроках химии
Формирование ключевых компетенций на уроках химии Горение жидкого топлива
Горение жидкого топлива Основные интермедиаты в органических реакциях. Часть 1
Основные интермедиаты в органических реакциях. Часть 1 Природные и синтетические полимеры
Природные и синтетические полимеры Е-числа в школьном буфете
Е-числа в школьном буфете Хімічний склад і використання мінералів
Хімічний склад і використання мінералів Непредельные углеводороды. Алкены
Непредельные углеводороды. Алкены Химия элементов IVA группы
Химия элементов IVA группы Физико-химические свойства белков. Электрофоретические и хроматографические методы
Физико-химические свойства белков. Электрофоретические и хроматографические методы Гидролиз органических и неорганических соединений
Гидролиз органических и неорганических соединений Минералы и их основные морфологические характеристики
Минералы и их основные морфологические характеристики Неметаллы: общая характеристика
Неметаллы: общая характеристика Железо. Соединения железа
Железо. Соединения железа Сахароза
Сахароза Железо
Железо Көміртекті материалдар
Көміртекті материалдар Аммиак. Состав вещества
Аммиак. Состав вещества Способы выражения концентрации растворов
Способы выражения концентрации растворов