Содержание
- 2. Нахождение в природе Железо занимает второе место по распространенности в природе. Содержание железа в земной коре
- 3. В земной коре 5,1% железа, 2 место после алюминия. По запасам железных руд Россия занимает 1
- 4. Биологическая Железо входит в состав гемоглобина, миоглобина, различных ферментов и других сложных железо -белковых комплексов, которые
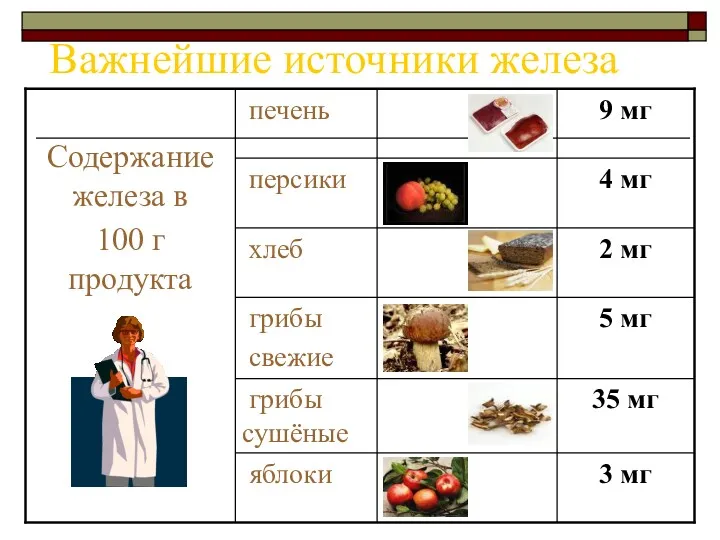
- 5. Важнейшие источники железа
- 8. Химические свойства Железо является сравнительно активным металлом и при повышенной температуре реагирует как с простыми, так
- 9. 3. Железо активно реагирует с хлором, а при нагревании и с другими неметаллами. 2Fe + 3Cl2
- 10. Химические свойства Fe + Fe2O3 =3FeO Fe + 5CO = Fe(CO)5 2FeCl2 + Cl2 = 2FeCl3
- 11. 3- Взаимодействие с разбавленными кислотами
- 12. 4- С растворами солей ОПЫТ Если опустить железный гвоздь в раствор сульфата меди, то на поверхности
- 13. 5- Со щелочами
- 15. Cпособы получения Fe2O3 + 3H2 =2Fe + 3H2O 3Fe3O4 + 8Al = 9Fe + 4Al2O3 FeCl2
- 16. Железо известно очень давно. Это самый распространенный в земной коре металл (около 4% по массе) и
- 17. Железо - самый употребляемый металл, на него приходится до 90 % мирового производства металлов. Чистое железо
- 19. Скачать презентацию















 Щелочные металлы IА группы. Литий
Щелочные металлы IА группы. Литий Эфирные масла
Эфирные масла Проект установки каталитического риформинга мощностью 1200 тыс. тонн
Проект установки каталитического риформинга мощностью 1200 тыс. тонн Хімічні властивості алканів
Хімічні властивості алканів Периодическая система химических элементов Д.И. Менделеева. Игра
Периодическая система химических элементов Д.И. Менделеева. Игра Аминокислоты N H2 – C H – C O O H
Аминокислоты N H2 – C H – C O O H Окислительновосстановительные реакции (ОВР)
Окислительновосстановительные реакции (ОВР) Сапалық талдау. Сапалық аналитикалық реакциялар
Сапалық талдау. Сапалық аналитикалық реакциялар Азотсодержащие соединения. Амины. Аминокислоты
Азотсодержащие соединения. Амины. Аминокислоты Методы окислительно-восстановительного и комплексонометри-ческого титрования
Методы окислительно-восстановительного и комплексонометри-ческого титрования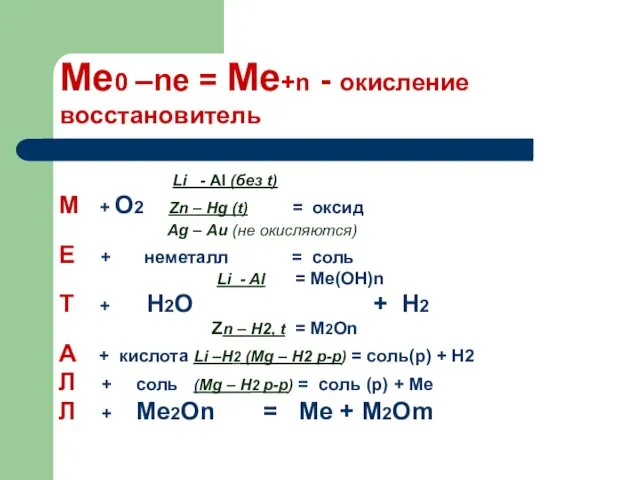 Коррозия металлов
Коррозия металлов Chem reactions. Different Typesof Chemical Reactions
Chem reactions. Different Typesof Chemical Reactions Анализ качества неорганических лекарственных средств количественно определяемых методами редоксиметрии
Анализ качества неорганических лекарственных средств количественно определяемых методами редоксиметрии Минеральные удобрения
Минеральные удобрения Физические свойства карбоновых кислот. Общие химические свойства неорганических и органических кислот. 10 класс
Физические свойства карбоновых кислот. Общие химические свойства неорганических и органических кислот. 10 класс Основные химические понятия
Основные химические понятия Термохимия. Термохимические уравнения
Термохимия. Термохимические уравнения Алкены. Гомологический ряд и изомерия
Алкены. Гомологический ряд и изомерия Алюминий. Сплавы алюминия
Алюминий. Сплавы алюминия Комбинированные задачи. 11 класс
Комбинированные задачи. 11 класс Щелочные металлы
Щелочные металлы Органічні сполуки. Предмет органічної хімії
Органічні сполуки. Предмет органічної хімії Характеристика химического элемента по его положению в периодической системе элементов Д.И.Менделеева
Характеристика химического элемента по его положению в периодической системе элементов Д.И.Менделеева Основные особенности композитов по сравнению с традиционными материалами
Основные особенности композитов по сравнению с традиционными материалами Исследование снежного покрова
Исследование снежного покрова Установка изомеризации пентан гексановой фракции
Установка изомеризации пентан гексановой фракции Основи. Фізичні властивості основ
Основи. Фізичні властивості основ Растворимость, ее зависимость от разных факторов. Насыщенные и ненасыщенные растворы. Физико-химическая сущность растворения
Растворимость, ее зависимость от разных факторов. Насыщенные и ненасыщенные растворы. Физико-химическая сущность растворения