Содержание
- 2. Основные химические понятия Химическое вещество Атом. Молекула. Индекс. Химический элемент Относительная атомная масса Молекулярные - Немолекулярные
- 3. Атомно-молекулярное учение (АМУ) Все вещества состоят из молекул. Молекулы состоят из атомов. Атомы характеризуются определенными размерами
- 4. Основные химические законы Закон сохранения массы веществ закон сохранения энергии Закон постоянства состава Законы стехиометрии: Закон
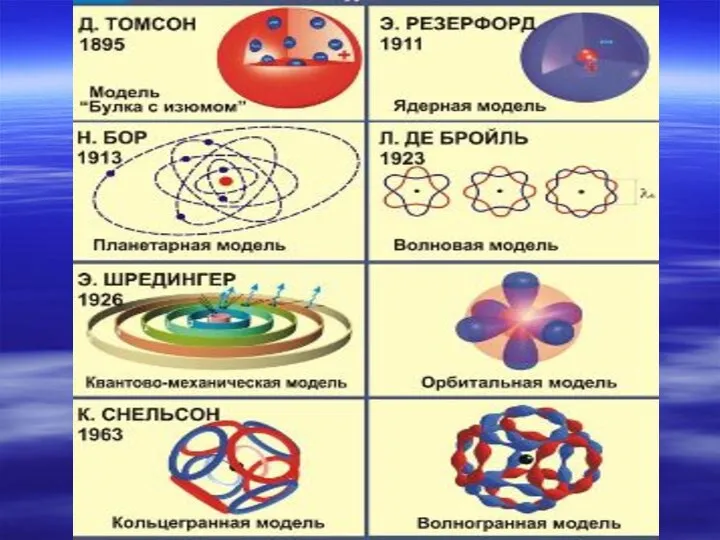
- 5. Эрнест Резерфорд (1871–1937) Один из крупнейших ученых в области радиоактивности и строения атома. Открыл три вида
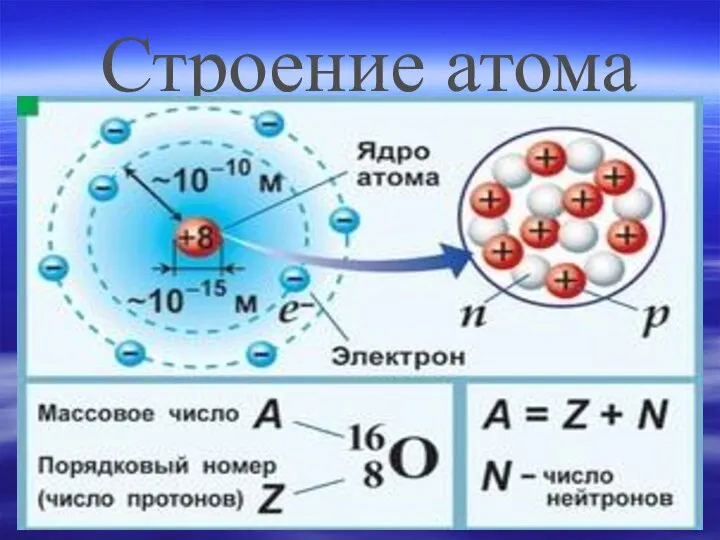
- 6. Строение атома
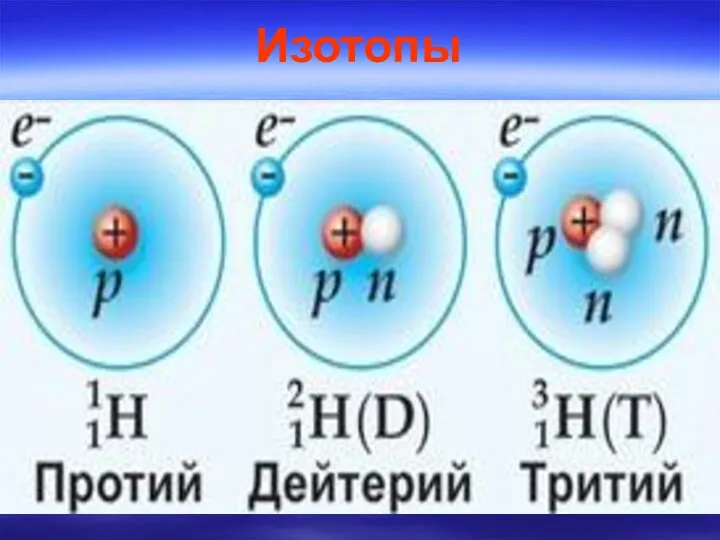
- 7. Изотопы
- 9. Постулаты Бора Электрон может вращаться вокруг ядра только по определенным стационарным орбитам и при этом обладает
- 10. Уравнение (М. Планк, 1900) атомы излучают энергию порциями, кратными некоторой минимальной величине - кванту, фотону –
- 11. Принцип корпускулярно-волнового дуализма При движении электронов проявляются их волновые свойства При взаимодействии с веществом – корпускулярные
- 12. Принцип неопределенности (В. Гейзенберг, 1925) Движение электрона в атоме не может быть описано определённой траекторией Положение
- 13. Атомная орбиталь (АО) - область наиболее вероятного пребывания электрона (электронное облако) в электрическом поле ядра атома.
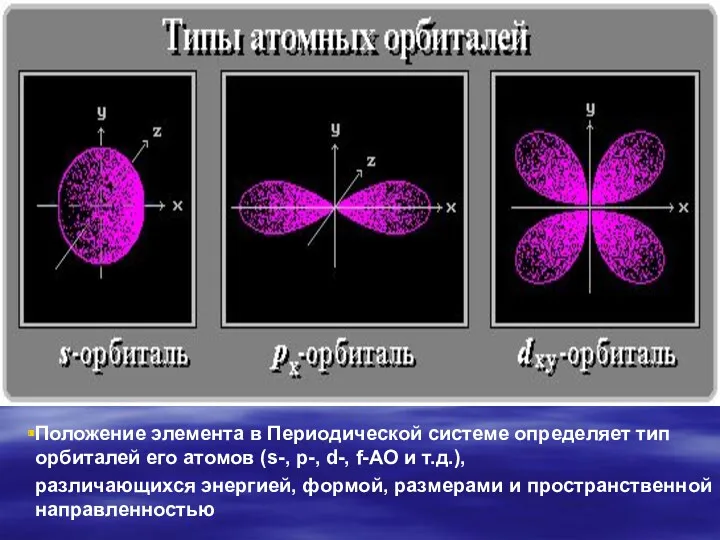
- 14. Положение элемента в Периодической системе определяет тип орбиталей его атомов (s-, p-, d-, f-АО и т.д.),
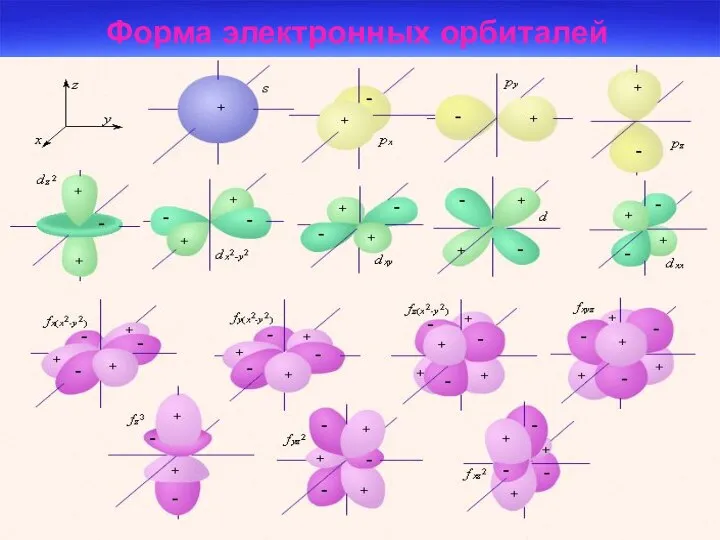
- 15. Форма электронных орбиталей
- 16. Объем сферы увеличивается с ростом энергетического уровня: 1s
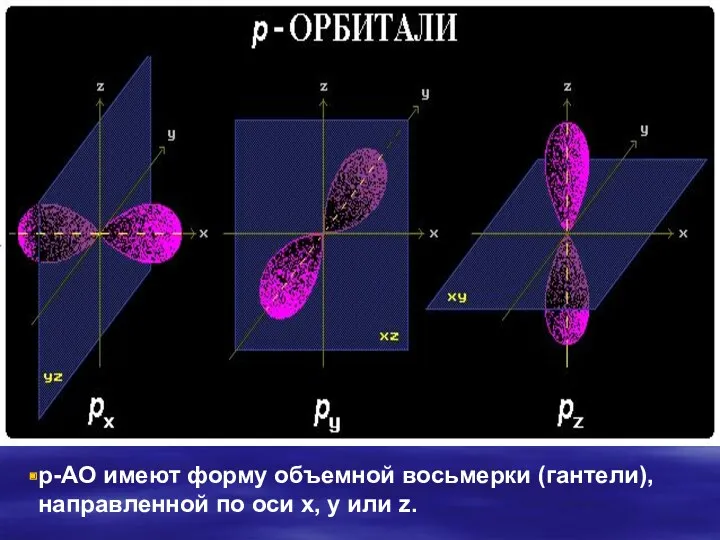
- 17. р-АО имеют форму объемной восьмерки (гантели), направленной по оси x, y или z.
- 18. Квантовые числа Главное квантовое число (целое число, обозначающее номер энергетического уровня) – характеризует энергию электрона в
- 19. Главное квантовое число(n) n - 1, 2, 3,…∞, определяет энергию электрона в атоме Энергетический уровень -
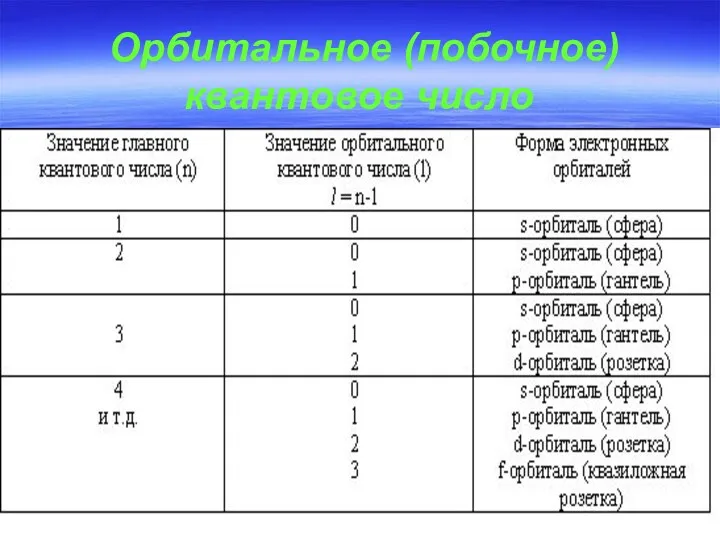
- 20. Орбитальное квантовое число (l) харакТЕРИЗУЕТ форму электронного облака l = 0, 1, 2, 3….n-1 Подуровень: s,
- 21. Орбитальное (побочное) квантовое число
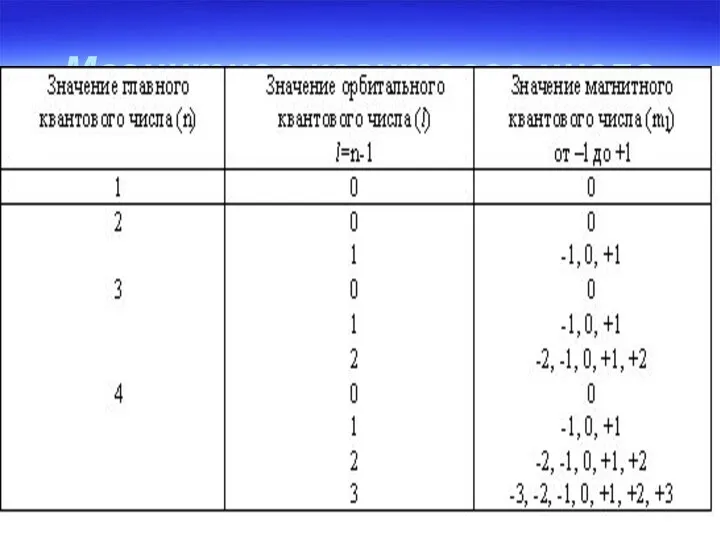
- 22. Магнитное квантовое число (ml) характеризует ориентацию электронных облаков в пространстве ml меняется от –l до +l,
- 23. Магнитное квантовое число
- 24. Спиновое квантовое число (ms) характеризует собственный магнитный момент электрона, который или совпадает с ориентацией орбитального момента,
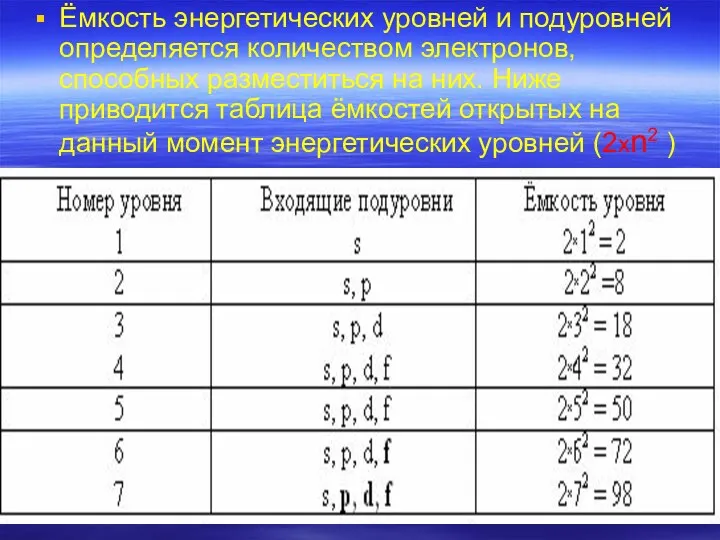
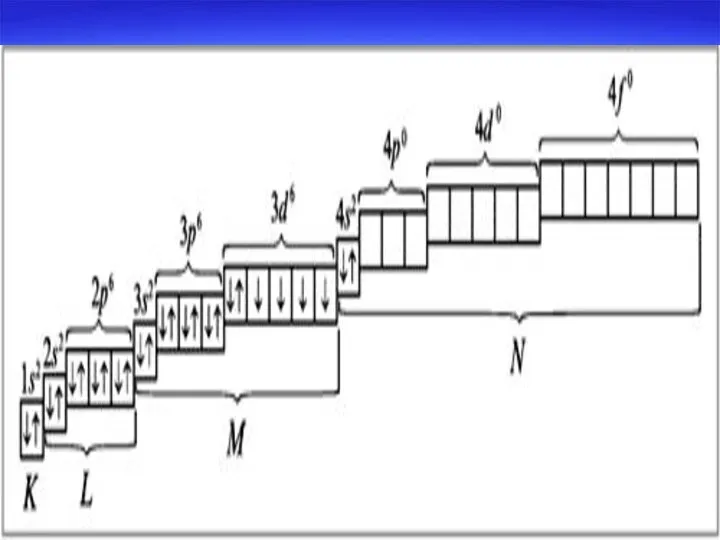
- 25. Ёмкость энергетических уровней и подуровней определяется количеством электронов, способных разместиться на них. Ниже приводится таблица ёмкостей
- 26. Атомная орбиталь (АО) это состояние электрона в атоме, которое описывается волновой функцией с набором из трех
- 27. Размещение электронов по энергетическим уровням и подуровням подчиняется следующим положениям: Принцип наименьшей энергии – каждый электрон
- 28. Вольфганг Эрнест Паули (1900-1958) Выдающийся швейцарский физик, один из авторов современной теории строения атома. Изучал спектры
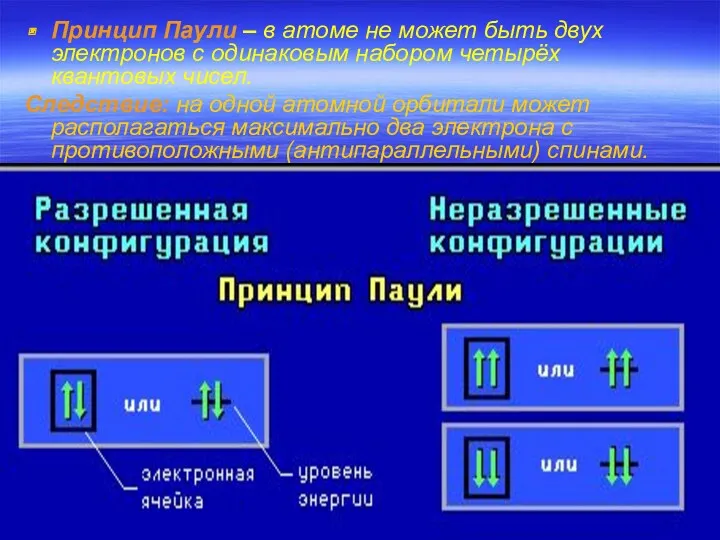
- 29. Принцип Паули – в атоме не может быть двух электронов с одинаковым набором четырёх квантовых чисел.
- 30. Правило Хунда – заполнение вырожденных орбиталей осуществляется в соответствии с максимальным суммарным спином, (то есть электроны,
- 31. Правила Клечковского Правило первое: электроны заполняют энергетические уровни в направлении увеличения суммы значений главного и орбитального
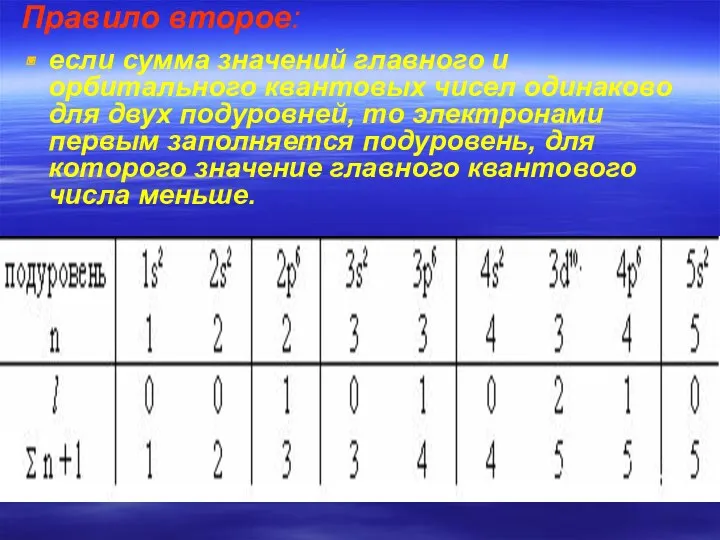
- 32. Правило второе: если сумма значений главного и орбитального квантовых чисел одинаково для двух подуровней, то электронами
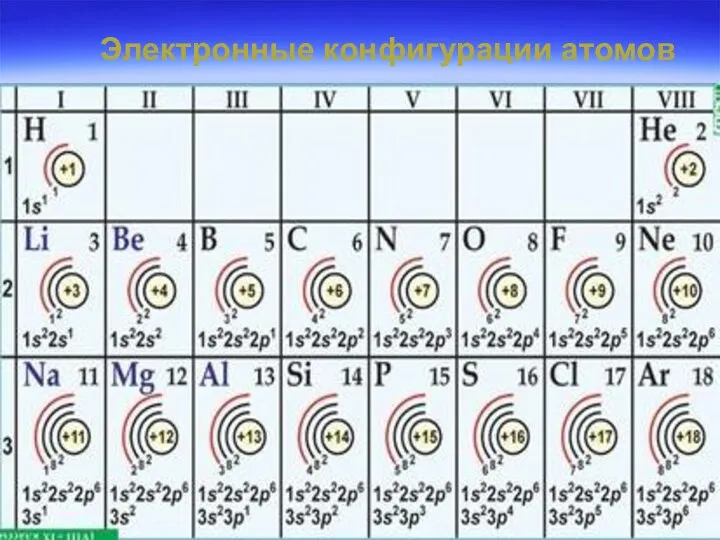
- 34. Полная электронная формула 22Ti - 1s22s22p63s23p64s23d2 Краткая формула Ti - 4s23d2 Электронно-графическая формула Ti 4 3
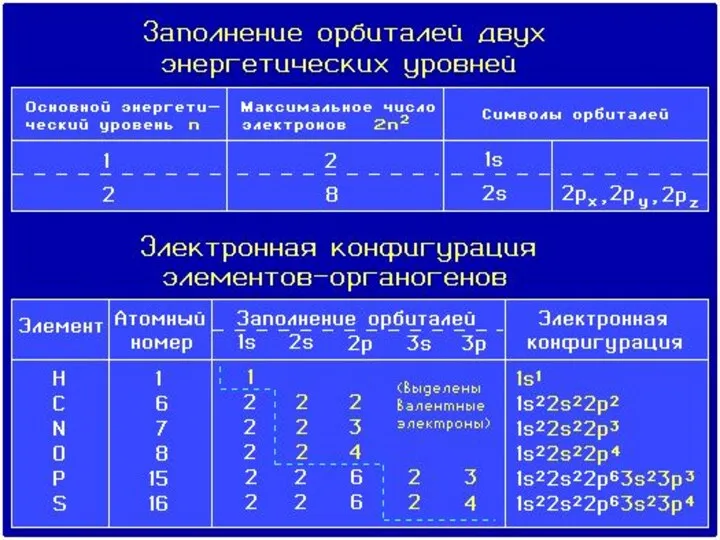
- 36. Электронные конфигурации атомов
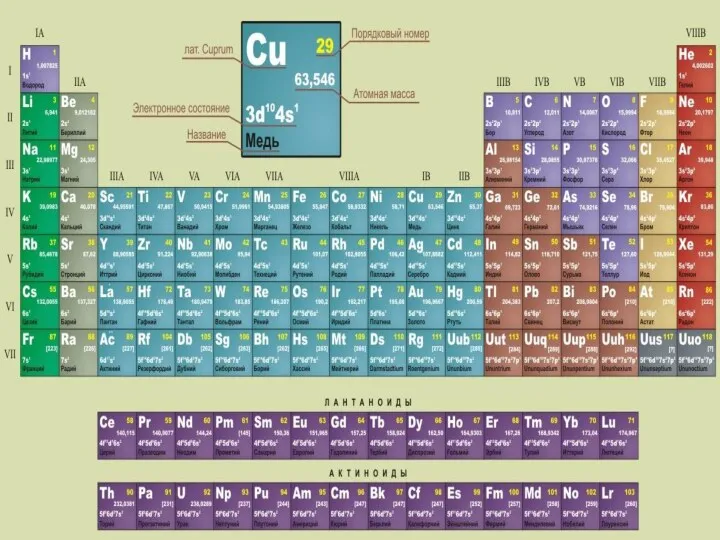
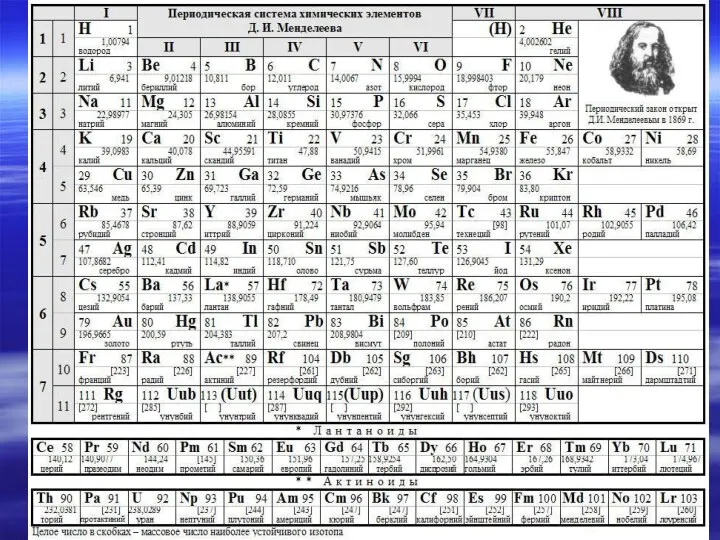
- 37. Периодический закон Д.И.Менделеева Свойства простых тел, а также формы и свойства соединений элементов, находятся в периодической
- 40. 1 период (n=1): (2n2) 2 элемента (1s2) 2 период (n=2): (2n2) 8 элементов (2s22p6) 3 период
- 41. 4 период (n=4): (2n2 -2*7) 18 элементов (4s23d104p6) 5 период (n=5): (2n2 -2(7 + 9) )
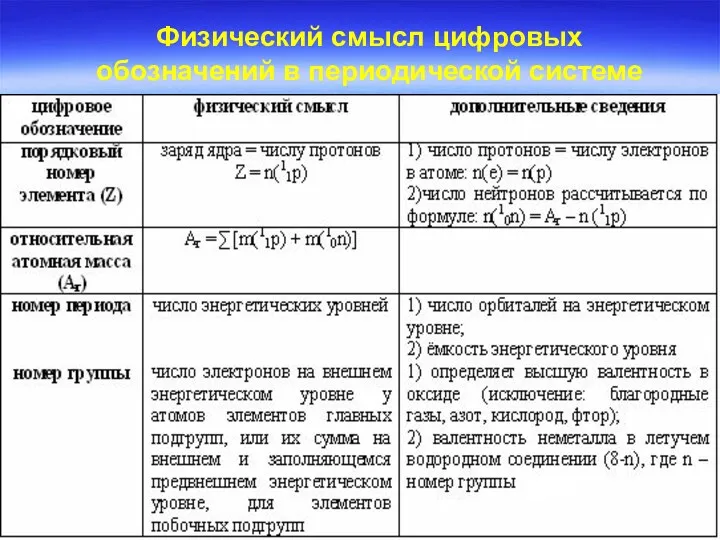
- 42. Физический смысл цифровых обозначений в периодической системе
- 43. Периодичность свойств элементов атомные и ионные радиусы энергия ионизации сродство к электрону электроотрицательность валентность элементов
- 44. Атомные и ионные радиусы химических элементов Орбитальный радиус атома (иона) – это расстояние от ядра до
- 45. Энергия и потенциал ионизации атомов Энергия ионизации – это энергия, необходимая для отрыва электрона от атома
- 46. Сродство к электрону это энергия, выделяющаяся или поглощающаяся при захвате электрона атомом или энергия, необходимая для
- 47. Электроотрицательность - свойство атома притягивать электроны от других атомов, с которыми он образует химическую связь в
- 48. Валентность Валентность определяется электронами внешнего уровня, поэтому высшая валентность элементов главных подгрупп равна номеру группы
- 49. Период – это горизонтальный ряд химических элементов, атомы которых отличаются числом электронов на внешнем или предвнешнем
- 50. Группа Группа – это вертикальный ряд элементов с одинаковой степенью окисления в высших оксидах. Каждая группа
- 51. Значение периодического закона Исходя из расположения химических элементов в периодической системе, периодичность их свойств объясняется электронной
- 52. ЛИТЕРАТУРА Глинка Н.Л. Общая химия: Учебное пособие для вузов/Под ред. А.И. Ермакова. – М.: Интеграл-Пресс, 2008.
- 53. 1. Какое из утверждений справедливо для понятия «атом»?: а) наименьшая частица вещества, существующая самостоятельно; б) электронейтральная
- 54. Перечислите частицы, которые входят в состав ядра атома: а) протоны, электроны; б) нейтроны, электроны; в) протоны,
- 55. Порядковый номер элемента соответствует в атоме: а) сумме числа протонов и числа нейтронов; б) сумме числа
- 56. Энергия сродства к электрону атомов с ростом атомного номера в периодах: а) не изменяется; б) нет
- 58. Скачать презентацию






































 Галогены
Галогены Коррозия металлов
Коррозия металлов Заключительный урок в 8 классе Тест по химии.
Заключительный урок в 8 классе Тест по химии. Технология производства сложных полиэфиров
Технология производства сложных полиэфиров Вред Coca-Cola на организм человека
Вред Coca-Cola на организм человека Оксиды и гидроксиды металлов. 11 класс
Оксиды и гидроксиды металлов. 11 класс Непредельные углеводороды
Непредельные углеводороды Аммиак
Аммиак Мыло
Мыло Олово и свинец
Олово и свинец Судың диссоциациялануы. Сутектік көрсеткіш. Тұздар гидролизі
Судың диссоциациялануы. Сутектік көрсеткіш. Тұздар гидролизі Химия в сельском хозяйстве. Химизация сельского хозяйства и ее направления
Химия в сельском хозяйстве. Химизация сельского хозяйства и ее направления Ультраосновные породы (гипербазиты)
Ультраосновные породы (гипербазиты) Коррозия металлов
Коррозия металлов Строение атома. Периодический закон и периодическая система элементов
Строение атома. Периодический закон и периодическая система элементов Кислородные соединения азота
Кислородные соединения азота Карбоновые кислоты
Карбоновые кислоты Total Synthesis of Aplysiasecosterol A
Total Synthesis of Aplysiasecosterol A Кислоты и основания. (Лекция 16)
Кислоты и основания. (Лекция 16) Stirring in liquid media
Stirring in liquid media Химия в быту
Химия в быту Ископаемые углеводороды
Ископаемые углеводороды NaHSO4. Гидросульфат натрия
NaHSO4. Гидросульфат натрия Современные тенденции развития химии
Современные тенденции развития химии Иондық байланыс
Иондық байланыс Вклад ученых-химиков в победу в Великой Отечественной войне
Вклад ученых-химиков в победу в Великой Отечественной войне ЕГЭ по химии. Анализ результатов решения (часть 2)
ЕГЭ по химии. Анализ результатов решения (часть 2) Органические и неорганические кислоты
Органические и неорганические кислоты