Содержание
- 2. 1. История открытия галогенов 2. Положение в ПСХЭ 3. Химические свойства 4. Применение 5.Проверка знаний Главная
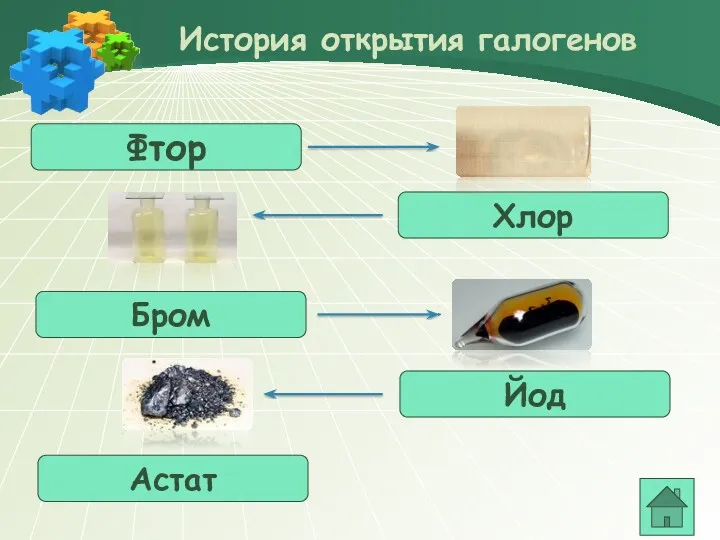
- 3. Фтор История открытия галогенов Хлор Бром Йод Астат
- 4. В 1886 году французский химик А. Муассан, используя электролиз жидкого фтороводорода, охлажденного до температуры –23°C, смог
- 5. В 1774 году шведский ученый К. Шееле открыл хлор, который принял за сложное вещество и назвал
- 6. В 1825 году французский химик А.Ж.Балар при изучении маточных рассолов выделил темно-бурую жидкость, который он назвал
- 7. В 1811 году французский химик Бернар Куртуа открыл иод путём перегонки маточных растворов от своего азотнокислого
- 8. Строение атомов (самостоятельно)
- 9. Группы элементов I III II VIII IV V VI VII II I III VII VI V
- 10. Группы элементов I III II VIII IV V VI VII II I III VII VI V
- 11. Группы элементов I III II VIII IV V VI VII II I III VII VI V
- 12. Группы элементов I III II VIII IV V VI VII II I III VII VI V
- 13. Группы элементов I III II VIII IV V VI VII II I III VII VI V
- 14. Группы элементов I III II VIII IV V VI VII II I III VII VI V
- 15. Химические свойства Взаимодействие с металлами: 2К + Cl2→ 2КCl 2Fe + 3Cl2 → 2FeCl3 Cu +
- 16. Химические свойства Взаимодействие с неметаллами: А) с водородом H2 + F2 → 2HF +Q Скорость H2
- 17. Химические свойства Взаимодействие со сложными веществами: А) с водой 2H2O + F2 → 4HF + O2
- 18. Химические свойства Взаимодействие со сложными веществами: Б) «ряд активности» галогенов F2 > Cl2 > Br2 >
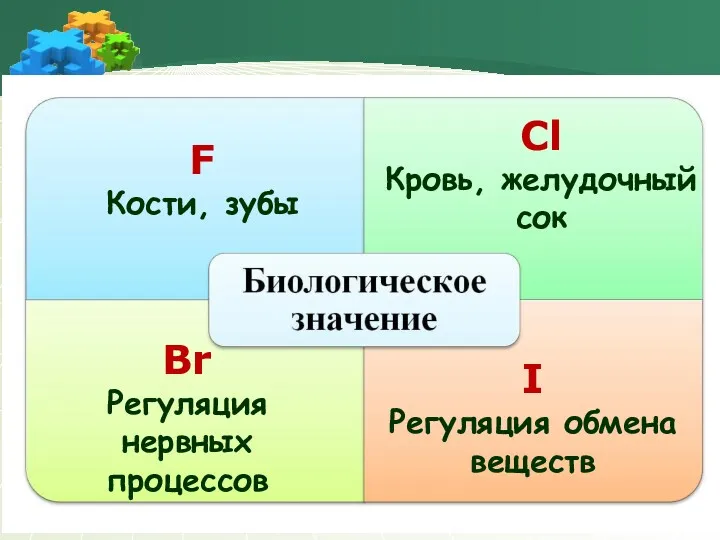
- 19. F Кости, зубы Сl Кровь, желудочный сок Br Регуляция нервных процессов I Регуляция обмена веществ
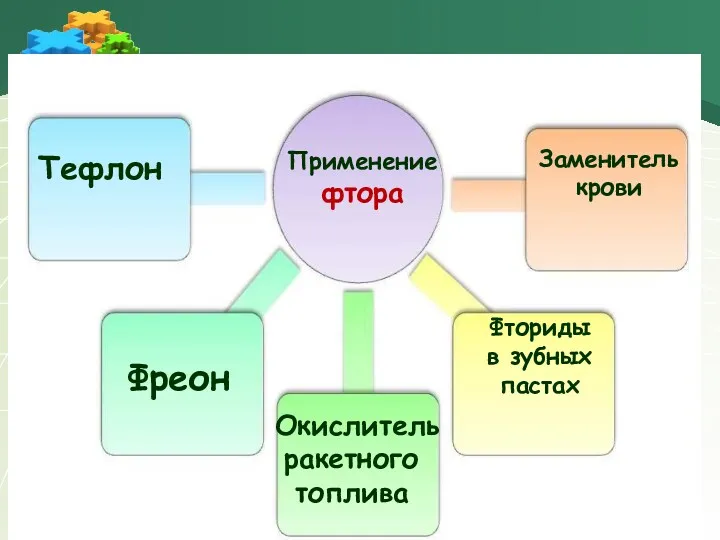
- 20. Применение фтора Тефлон Фреон Окислитель ракетного топлива Заменитель крови Фториды в зубных пастах
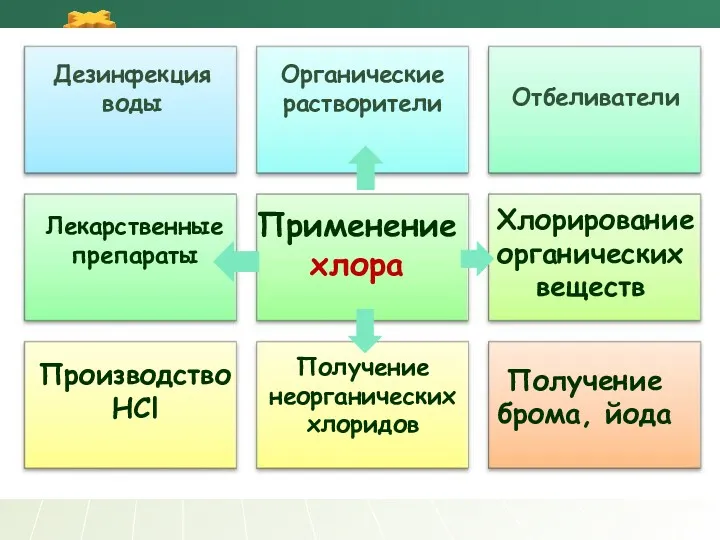
- 21. Применение хлора Отбеливатели Производство HCl Получение брома, йода Дезинфекция воды Органические растворители Лекарственные препараты Хлорирование органических
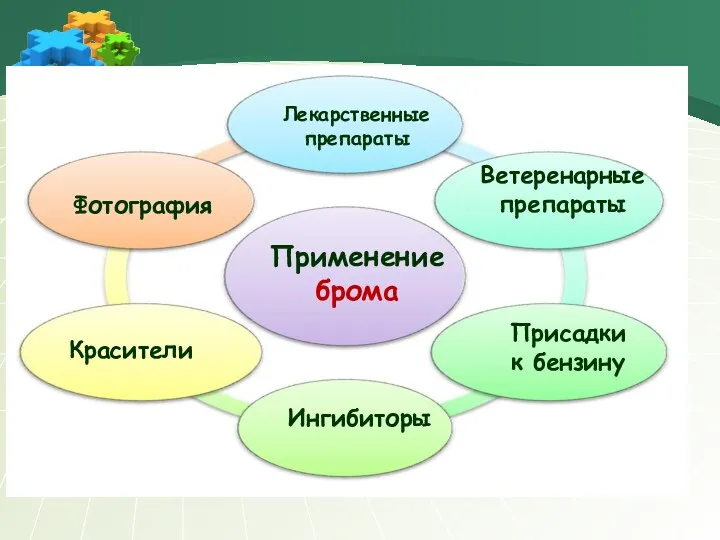
- 22. Применение брома Лекарственные препараты Красители Фотография Ветеренарные препараты Ингибиторы Присадки к бензину
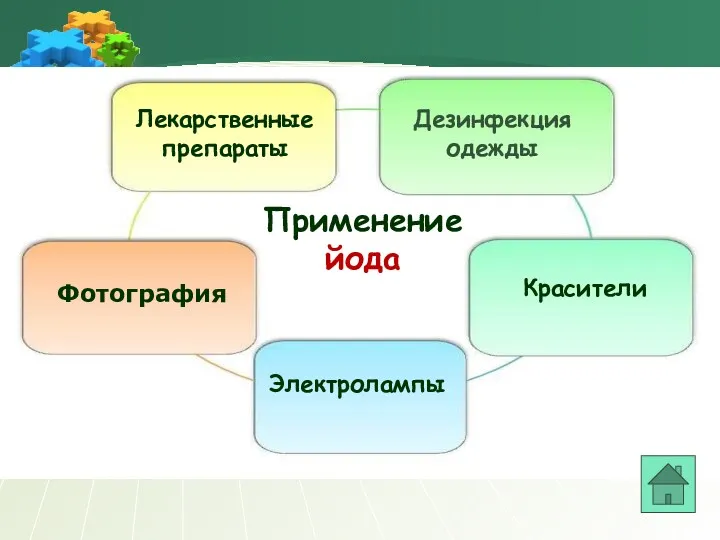
- 23. Применение йода Лекарственные препараты Фотография Красители Дезинфекция одежды Электролампы
- 24. Химические свойства галогенов Вставьте коэффициенты: Na + Cl2 = NaCl S + F2 = SF6 Fe
- 25. Подумайте… Что образуется в данной реакции, оксид фтора или фторид кислорода? F2 + O2 →
- 27. Скачать презентацию


















 Химия в продуктах питания
Химия в продуктах питания Теория электролитической диссоциации. Кислотно-основные равновесия в водных растворах
Теория электролитической диссоциации. Кислотно-основные равновесия в водных растворах Курс коллоидной химии
Курс коллоидной химии Характеристика АХОВ и их поражающих факторов
Характеристика АХОВ и их поражающих факторов Химическая кинетика
Химическая кинетика Карбонільні сполуки - альдегіди та кетони
Карбонільні сполуки - альдегіди та кетони Алкены
Алкены Изотопы химических элементов
Изотопы химических элементов Алкандар. Метан молекуласының құрылысы Метан және оның гомологтарының қасиеттері
Алкандар. Метан молекуласының құрылысы Метан және оның гомологтарының қасиеттері Смеси, растворы. Тест
Смеси, растворы. Тест Коррозия металлов. Причины коррозии металлов
Коррозия металлов. Причины коррозии металлов Водород. Урок химии
Водород. Урок химии Сахар - вред или польза?
Сахар - вред или польза? химиияяяяяяяяяяяяяяяяяяяяяяяяяяяяяяяяя
химиияяяяяяяяяяяяяяяяяяяяяяяяяяяяяяяяя Приемы обращения с лабораторным оборудованием
Приемы обращения с лабораторным оборудованием Залізо. Фізичні та хімічні властивості
Залізо. Фізичні та хімічні властивості Массовая доля вещества в растворе. Урок химии. 8 класс
Массовая доля вещества в растворе. Урок химии. 8 класс Дисперсная система
Дисперсная система Циклические углеводороды. Циклоалканы
Циклические углеводороды. Циклоалканы Углеводороды (классификация и номенклатура)
Углеводороды (классификация и номенклатура) Вольфрам — химический элемент
Вольфрам — химический элемент Физические и химические свойства оснований
Физические и химические свойства оснований Отримання кисню. Властивості кисню
Отримання кисню. Властивості кисню Галогени. Знаходження в природі
Галогени. Знаходження в природі Щелочноземельные металлы
Щелочноземельные металлы Плавление и кристаллизация
Плавление и кристаллизация Получение, собирание, распознавание газов. (Практическая работа 2)
Получение, собирание, распознавание газов. (Практическая работа 2) Соединения кремния
Соединения кремния