Содержание
- 2. НАСИЧЕНІ АЛЬДЕГІДИ ТА КЕТОНИ За номенклатурою IUPAC альдегіди називають за назвою відповідного вуглеводня з додаванням закінчення
- 3. Назви альдегідів і кетонів
- 4. СПОСОБИ ОДЕРЖАННЯ 1. Окиснення 1.1. Окиснення або каталітичне дегідрування спиртів Як окиснювач найчастіше використовується кисень повітря
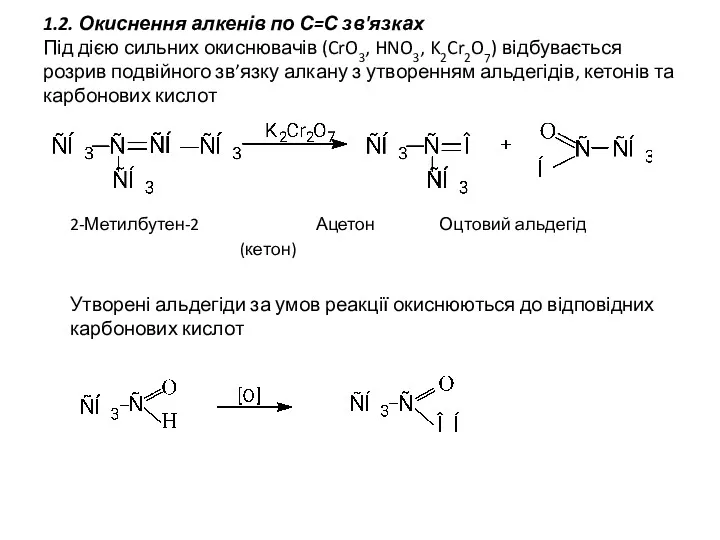
- 5. 1.2. Окиснення алкенів по С=С зв'язках Під дією сильних окиснювачів (CrO3, HNO3, K2Cr2O7) відбувається розрив подвійного
- 6. 1.3. Окиснення алканів Важливою промисловою реакцією є каталітичне окиснення метану до формальдегіду: 2. Реакція оксосинтезу (гідроформілювання
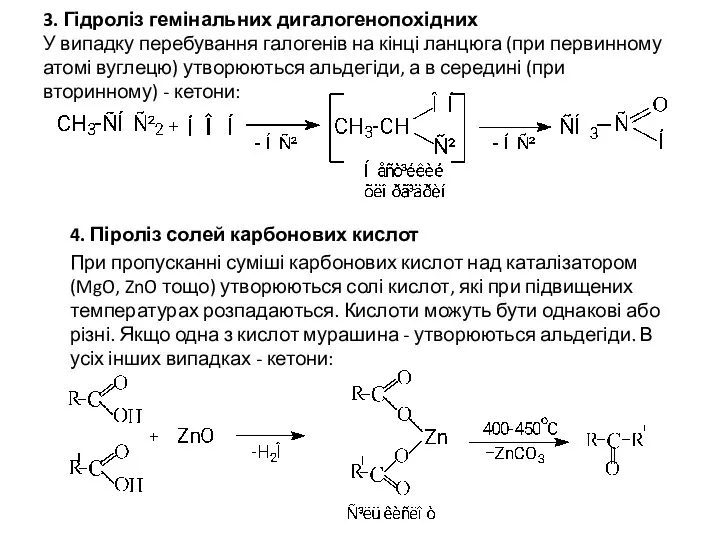
- 7. 3. Гідроліз гемінальних дигалогенопохідних У випадку перебування галогенів на кінці ланцюга (при первинному атомі вуглецю) утворюються
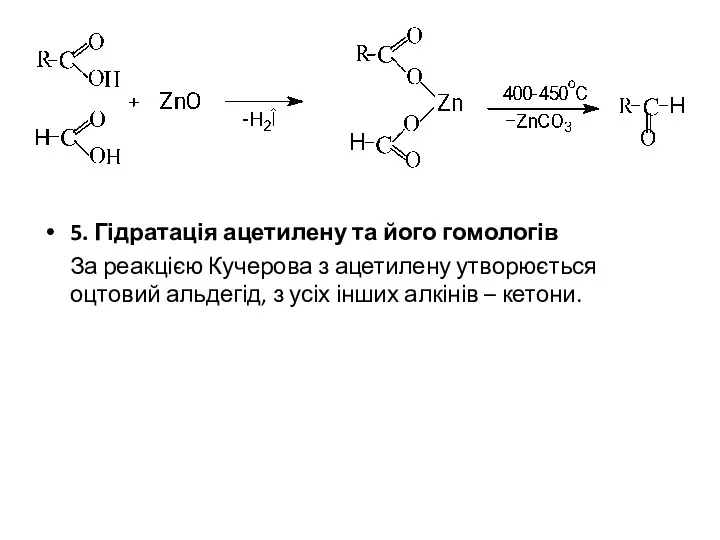
- 8. 5. Гідратація ацетилену та його гомологів За реакцією Кучерова з ацетилену утворюється оцтовий альдегід, з усіх
- 9. ФІЗИЧНІ ВЛАСТИВОСТІ Насичені альдегіди та кетони - це безбарвні рідини. Метаналь - газ з різким запахом.
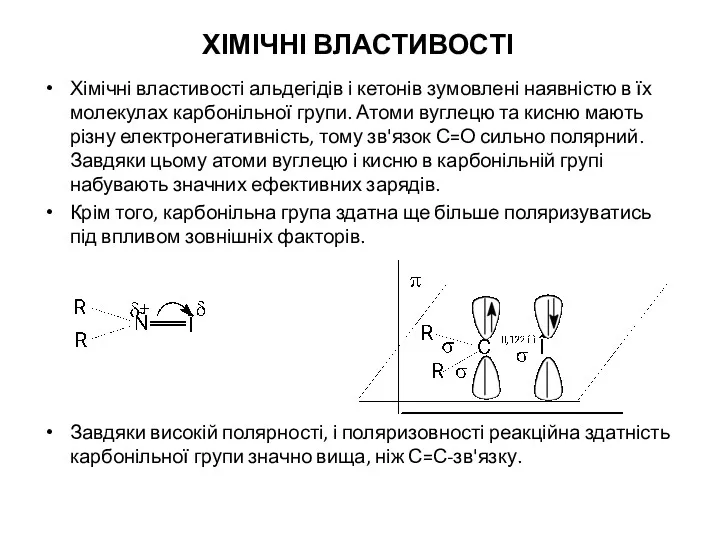
- 10. ХІМІЧНІ ВЛАСТИВОСТІ Хімічні властивості альдегідів і кетонів зумовлені наявністю в їх молекулах карбонільної групи. Атоми вуглецю
- 11. Вуглець карбонільної групи виявляє електрофільні властивості, а кисень - нуклеофільні. Завдяки цьому, атом вуглецю карбонільної групи
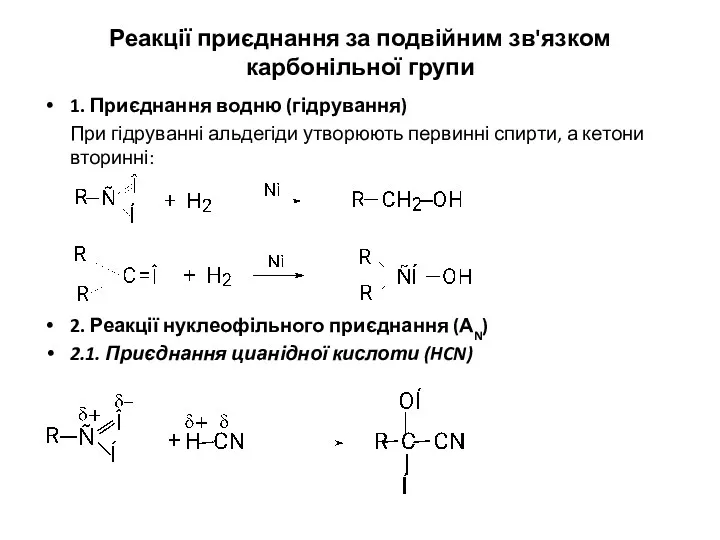
- 12. Реакції приєднання за подвійним зв'язком карбонільної групи 1. Приєднання водню (гідрування) При гідруванні альдегіди утворюють первинні
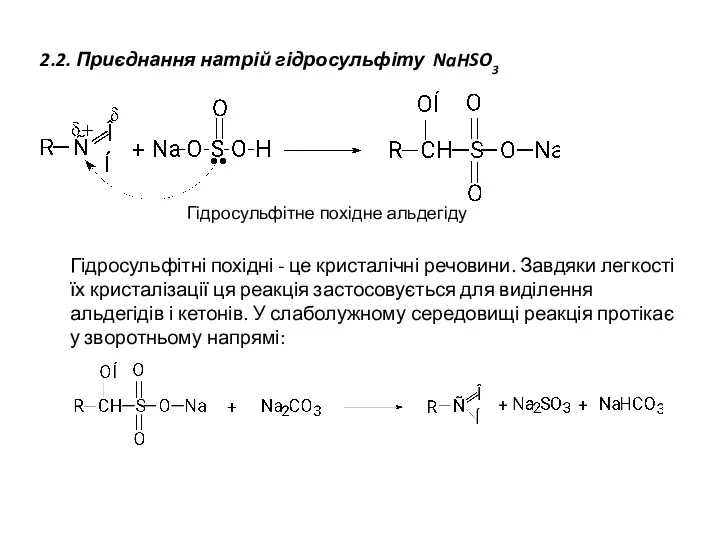
- 13. 2.2. Приєднання натрій гідросульфіту NaHSO3 Гідросульфітне похідне альдегіду Гідросульфітні похідні - це кристалічні речовини. Завдяки легкості
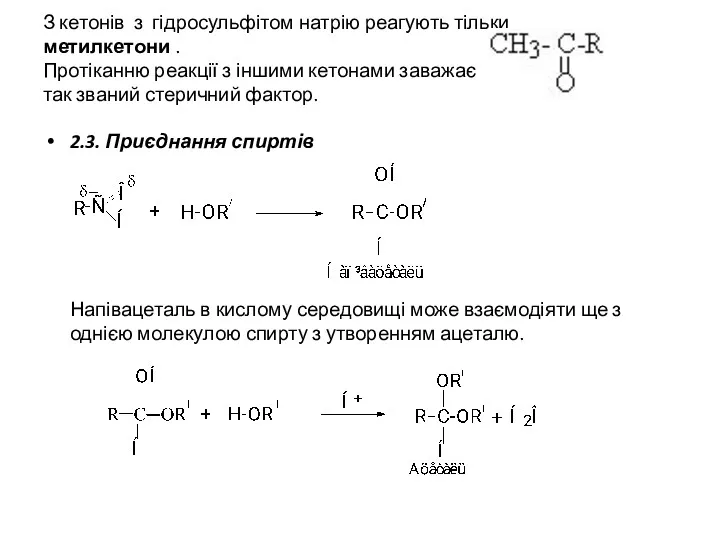
- 14. З кетонів з гідросульфітом натрію реагують тільки метилкетони . Протіканню реакції з іншими кетонами заважає так
- 15. Ацеталі при нагріванні з розведеними кислотами піддаються гідролізу: 2.5. Приєднання аміаку Альдегіди приєднують аміак з утворенням
- 16. 2.6. Взаємодія з гідроксиламіном (NH2OH) Дана реакція застосовується для кількісного визначення альдегідів і кетонів. При цьому
- 17. 2.7. Приєднання гідразину та його похідних Гідразин, аналогічно до аміаку і гідроксиламіну, приєднується до електрофільного атома
- 18. Аналогічно протікають реакції з фенілгідразином NH2-NH-C6H5. При цьому утворюються фенілгідразони: 2.9. Взаємодіяз галоген-нуклеофілами (РСІ5, PCl3) При
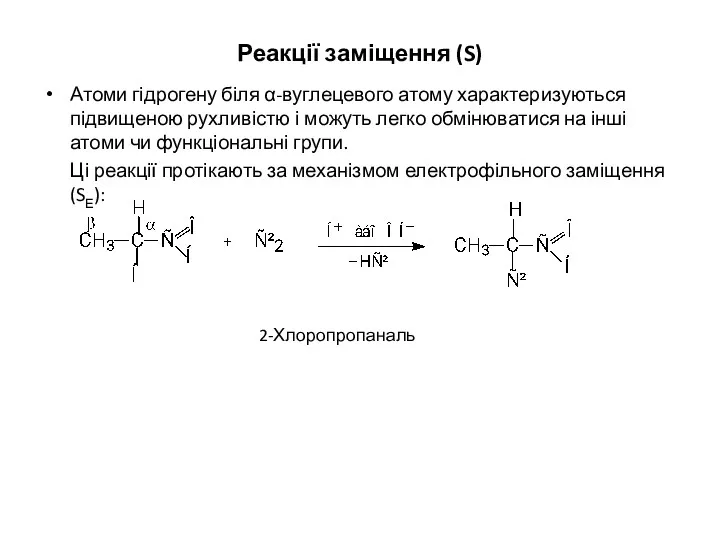
- 19. Реакції заміщення (S) Атоми гідрогену біля α-вуглецевого атому характеризуються підвищеною рухливістю і можуть легко обмінюватися на
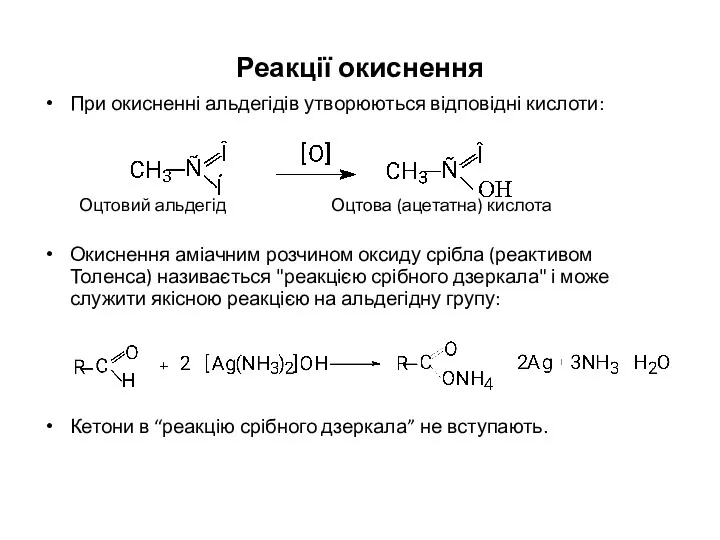
- 20. Реакції окиснення При окисненні альдегідів утворюються відповідні кислоти: Оцтовий альдегід Оцтова (ацетатна) кислота Окиснення аміачним розчином
- 21. Окиснення кетонів відбувається складніше і протікає лише в жорстких умовах. При їх окисненні спостерігається розрив вуглецевого
- 22. Реакції полімеризації і конденсації Реакції полімеризації характерні тільки для альдегідів. 1. Полімеризація формальдегіду У присутності певних
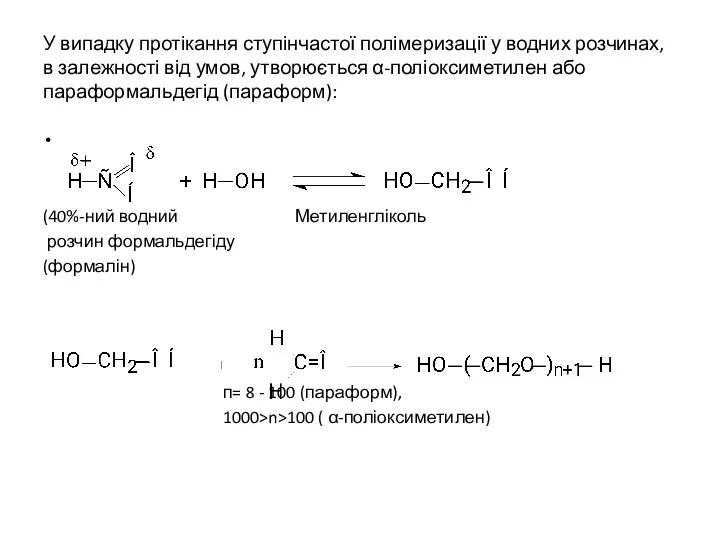
- 23. У випадку протікання ступінчастої полімеризації у водних розчинах, в залежності від умов, утворюється α-поліоксиметилен або параформальдегід
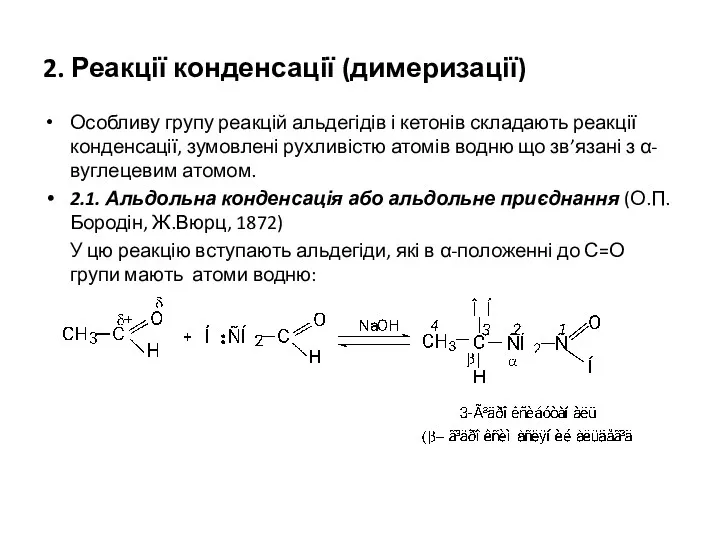
- 24. 2. Реакції конденсації (димеризації) Особливу групу реакцій альдегідів і кетонів складають реакції конденсації, зумовлені рухливістю атомів
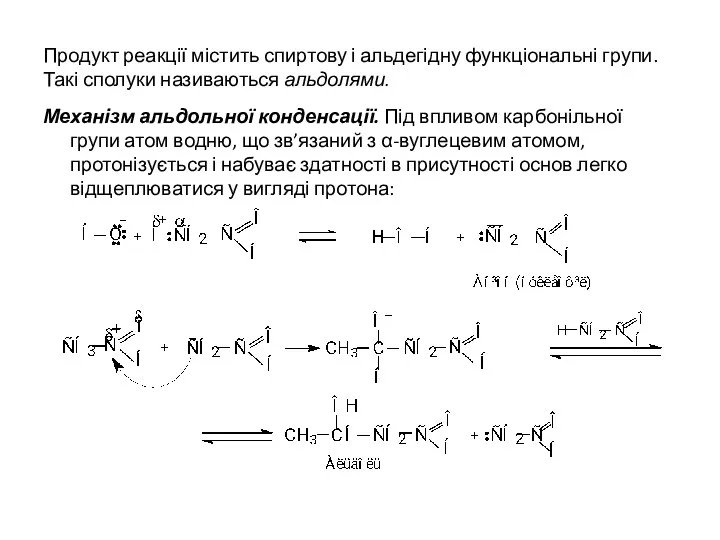
- 25. Продукт реакції містить спиртову і альдегідну функціональні групи. Такі сполуки називаються альдолями. Механізм альдольної конденсації. Під
- 26. 2.2. Кротонова конденсація Якщо утворений в результаті альдольної конденсації альдоль містить в α-положенні атоми водню, то
- 27. 2.3. Реакція диспропорціювання (Канніццаро 1853) (формальдегід і альдегіди) при α –вуглецевому атомі, які в α-положенні до
- 28. Отже, в лужному середовищі альдегіди, що містять хоча б один атом водню при α-вуглецевому атомі вступають
- 29. 2.4. Естерна конденсація (В.Є.Тищенко, 1906) У присутності алкоголяту алюмінію відбувається диспропорціювання альдегідів, тобто одна молекула альдегіду
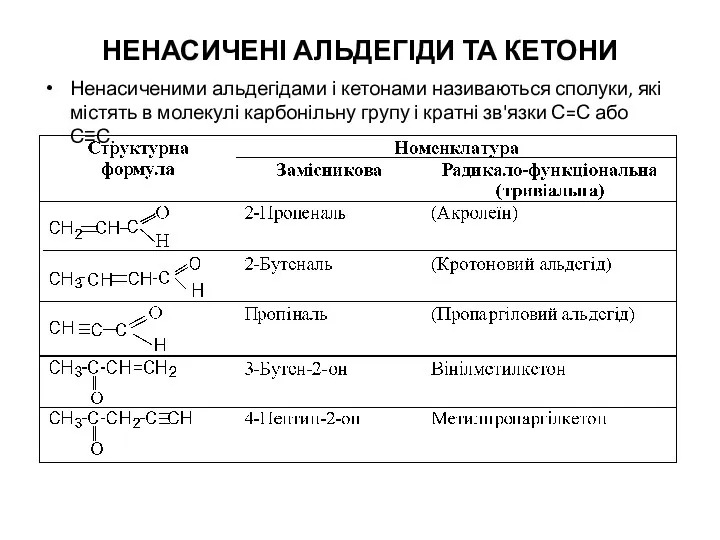
- 30. НЕНАСИЧЕНІ АЛЬДЕГІДИ ТА КЕТОНИ Ненасиченими альдегідами і кетонами називаються сполуки, які містять в молекулі карбонільну групу
- 31. Акролеїн (2-пропеналь) одержують кротоновою конденсацією суміші метаналю та етеналю через стадію альдолю: 3-Гідроксипропаналь Пропеналь (акролеїн) Крім
- 32. Кротоновий альдегід (2-бутеналь). Кротоновий альдегід отримують реакцією кротонової конденсації оцтового альдегіду. Вінілметилкетон (3-бутен-2-он) - кротоновою конденсацією
- 33. Хімічні властивості Хімічні властивості ненасичених альдегідів і кетонів залежать від взаємного розташування і впливу один на
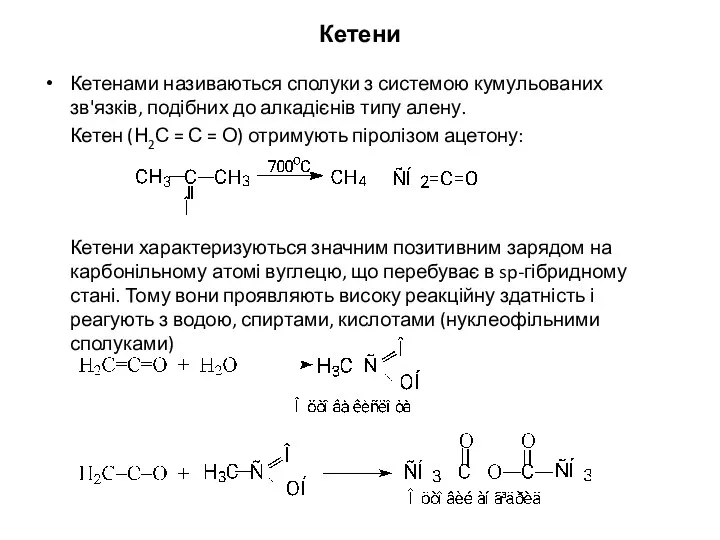
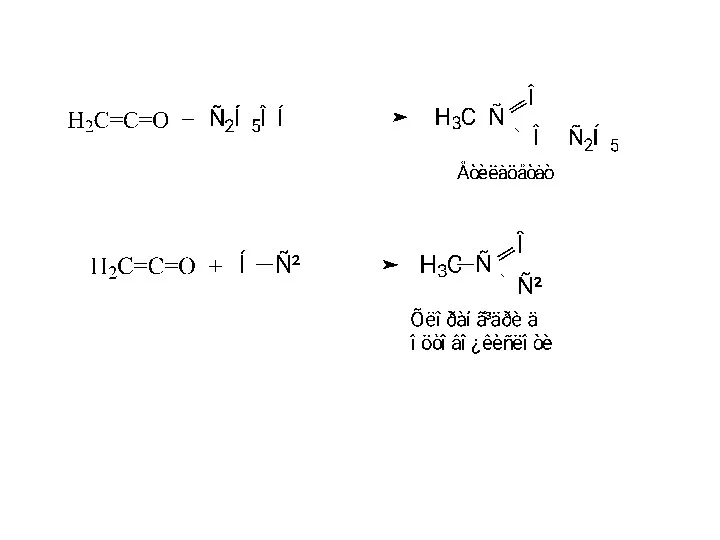
- 34. Кетени Кетенами називаються сполуки з системою кумульованих зв'язків, подібних до алкадієнів типу алену. Кетен (Н2С =
- 36. ДИКАРБОНІЛЬНІ СПОЛУКИ Сполуки, що містять дві карбонільні групи називаються діальдегідами і дикетонами. Етандіаль, гліоксаль (α-діальдегід) Пропандіаль,
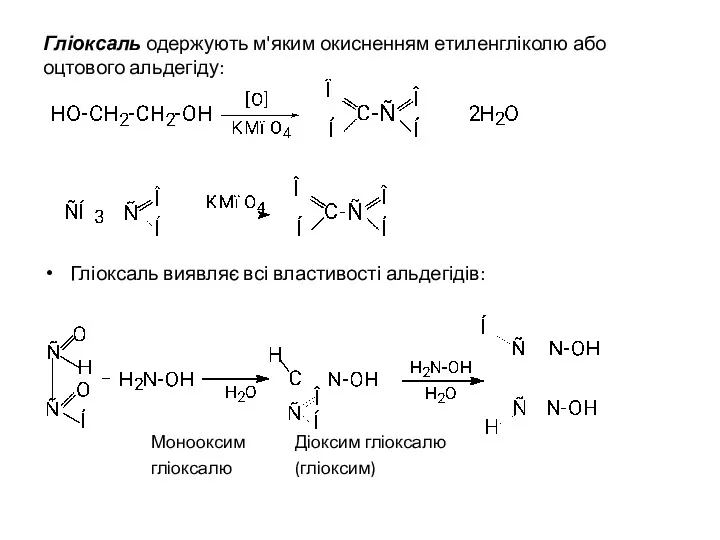
- 37. Гліоксаль одержують м'яким окисненням етиленгліколю або оцтового альдегіду: Гліоксаль виявляє всі властивості альдегідів: Монооксим Діоксим гліоксалю
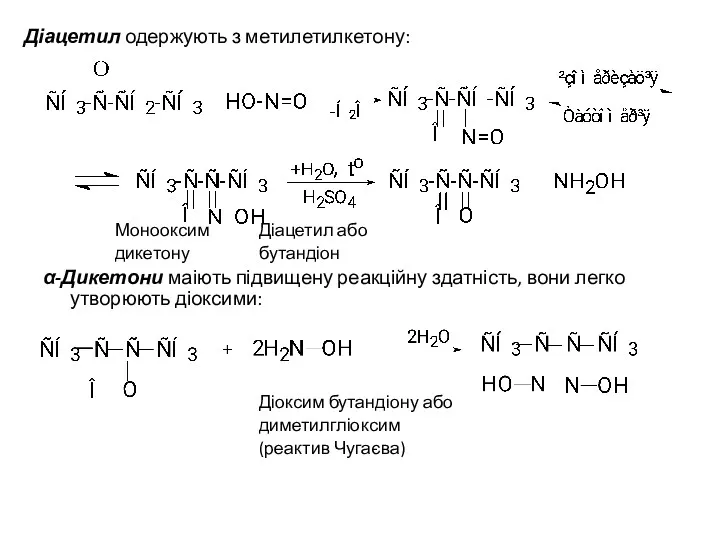
- 38. Діацетил одержують з метилетилкетону: Монооксим Діацетил або дикетону бутандіон α-Дикетони маіють підвищену реакційну здатність, вони легко
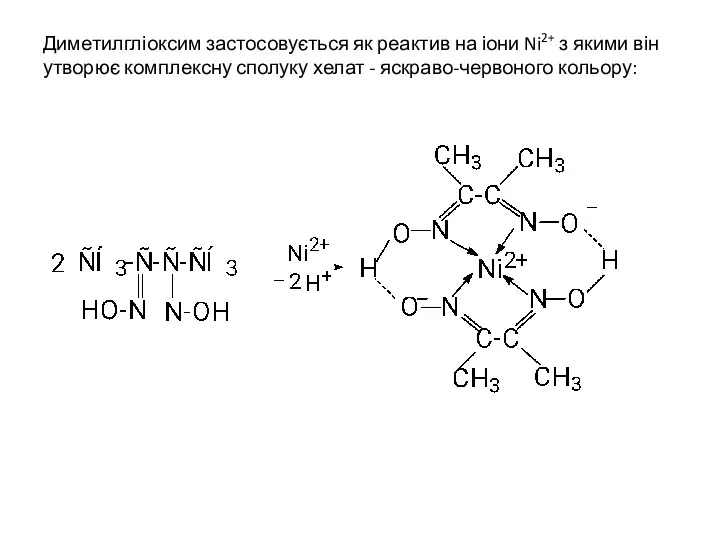
- 39. Диметилгліоксим застосовується як реактив на іони Ni2+ з якими він утворює комплексну сполуку хелат - яскраво-червоного
- 41. Скачать презентацию




















 Теория сильных и слабых электролитов
Теория сильных и слабых электролитов Применение здм к кислотно-основным равновесиям и их роль в аналитической химии
Применение здм к кислотно-основным равновесиям и их роль в аналитической химии Закономірності протікання хімічних реакцій
Закономірності протікання хімічних реакцій Трансформация энергии в процессе оксигенного фотосинтеза
Трансформация энергии в процессе оксигенного фотосинтеза Состав энергетических напитков
Состав энергетических напитков Найважливіші мікробіологічні процеси, збудники яких є мікроорганізми
Найважливіші мікробіологічні процеси, збудники яких є мікроорганізми Геохимия гранитоидов, зоны гипергенеза, осадочного процесса
Геохимия гранитоидов, зоны гипергенеза, осадочного процесса Валентность и степень окисления
Валентность и степень окисления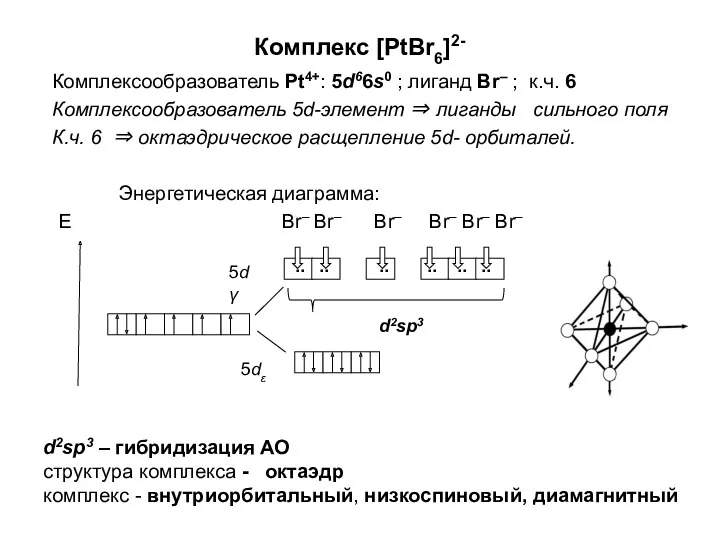 Комплексообразователь. (Лекция 5)
Комплексообразователь. (Лекция 5) Гидрокрекинг нефтяного сырья
Гидрокрекинг нефтяного сырья Свойства растворов высокомолекулярных соединений
Свойства растворов высокомолекулярных соединений Оксиды, их классификация и свойства (8 класс)
Оксиды, их классификация и свойства (8 класс) Отчет по исследовательской работе Образование АСПО
Отчет по исследовательской работе Образование АСПО Нуклеозиды. Нуклеиновые кислоты
Нуклеозиды. Нуклеиновые кислоты Аммиак. Строение, свойства, получение, применение
Аммиак. Строение, свойства, получение, применение Каталитические процессы нефтепереработки
Каталитические процессы нефтепереработки Основные понятия. Химический язык
Основные понятия. Химический язык Щелочные металлы
Щелочные металлы Chimia coordinativă
Chimia coordinativă Нефть - природный источник углеводородов
Нефть - природный источник углеводородов Монотерпеноиды. Химическое строение и общая характеристика. Тема № 2
Монотерпеноиды. Химическое строение и общая характеристика. Тема № 2 Химия нефти и газа
Химия нефти и газа Задачи на избыток-недостаток
Задачи на избыток-недостаток Чистые вещества и смеси
Чистые вещества и смеси Инертные газы
Инертные газы Классификация процессов и производств в химической технологии
Классификация процессов и производств в химической технологии Дисперсные системы (продолжение)
Дисперсные системы (продолжение) Органическая химия. Альдегиды и кетоны
Органическая химия. Альдегиды и кетоны