Содержание
- 2. Основные понятия темы вещество атом, молекула, ион химический элемент, простое вещество, сложное вещество, три агрегатных состояния
- 3. Вещество. Тело. Глина, железо, гвоздь, стекло, стакан, льдина, лед, медь, проволока. Когда речь идет о теле,
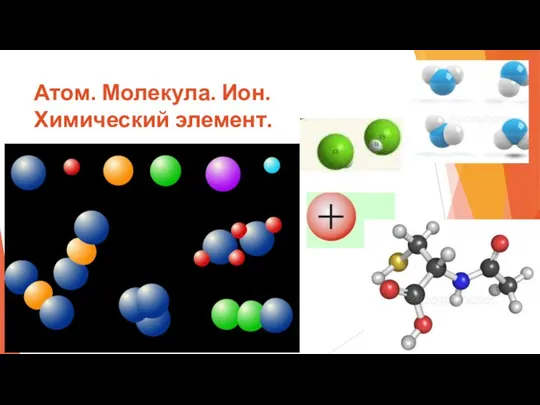
- 4. Атом. Молекула. Ион. Химический элемент. Вещества имеют дискретное строение, т.е. состоят из мельчайших частиц: атомов, ионов,
- 5. Атом. Молекула. Ион. Химический элемент.
- 6. Химический элемент и вещество.
- 7. Простое вещество. Сложное вещество. В состав вещества может входить и один химический элемент и несколько элементов.
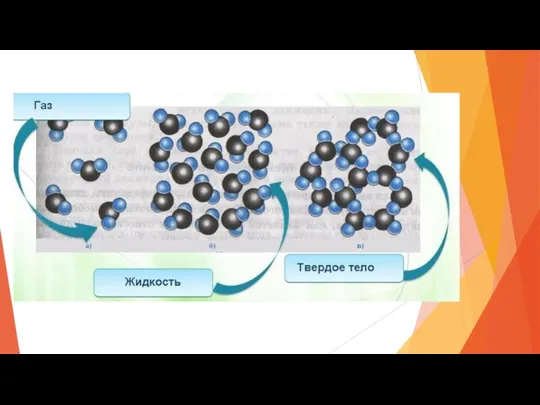
- 8. Три агрегатных состояния вещества В зависимости от условий, вещества могут находится в одном из трех агрегатных
- 10. От чего зависит в каком агрегатном состоянии находится вещество при стандартных условиях? Скорость и характер движения
- 11. Физические свойства. Физический процесс. Вещества обладают свойствами. Свойства веществ– это признаки по которым вещества похожи или
- 12. Физические свойства. Физический процесс. Назовите какое нибудь вещество. Опишите физические свойства вещества. Как называются процессы (явления)
- 13. Химические свойства. Химический процесс. Химические свойства проявляются в процессе превращения одних веществ в другие вещества. Этот
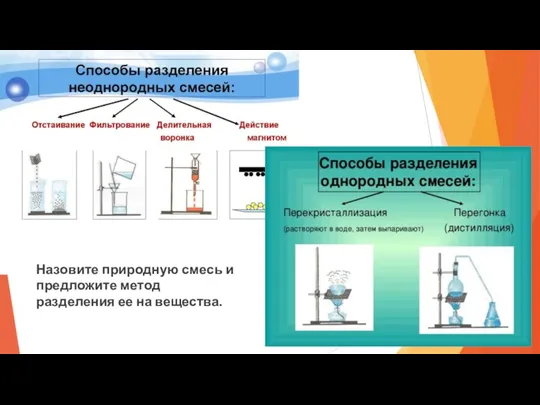
- 14. Чистые вещества и смеси. Закон постоянства состава вещества. Чистое вещество имеет определенный состав и определенные свойства
- 15. Состав смеси выражается с помощью массовой или объемной доли вещества в смеси. Вещество, содержащееся в меньшем
- 16. Назовите природную смесь и предложите метод разделения ее на вещества.
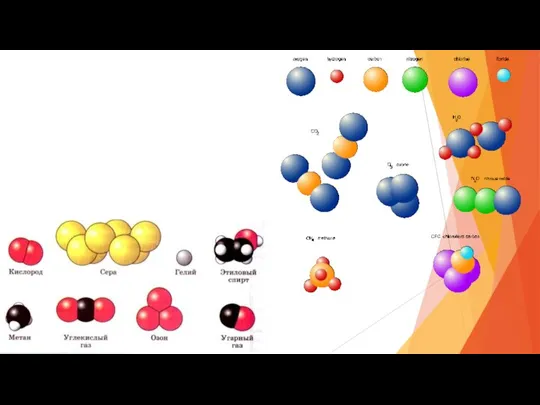
- 17. Химические знаки, химическая формула, индекс, коэффициент Химический знак - условное изображение химического элемента с помощью одной
- 20. Какую информацию мы можем извлечь из молекулярной формулы? Какие химические элементы входят в состав вещества? Сколько
- 21. Валентность - способность атомов химического элемента образовывать определенное число связей с атомами других элементов. Валентность –
- 22. Алгоритм вычисления валентности хим. элемента по формуле 1. Записать формулу и указать известную валентность (постоянную или
- 23. Алгоритм составления формул по валентности 1. Записать хим. знаки элементов и указать их валентность (постоянную или
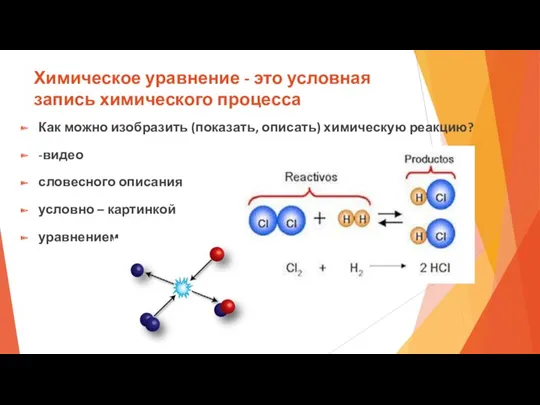
- 24. Химическое уравнение - это условная запись химического процесса Как можно изобразить (показать, описать) химическую реакцию? -видео
- 25. Алгоритм составления уравнений реакций. В левой части записываются формулы веществ, вступивших в реакцию (исходные вещества), в
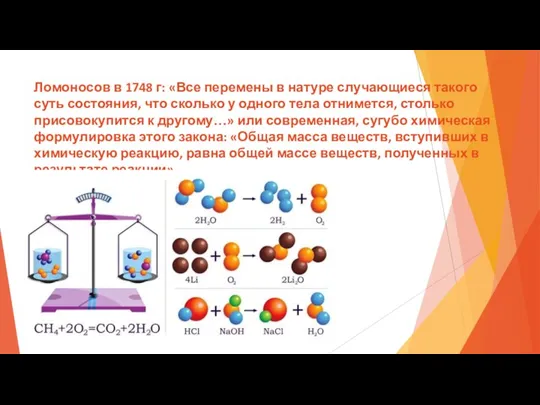
- 26. Ломоносов в 1748 г: «Все перемены в натуре случающиеся такого суть состояния, что сколько у одного
- 27. Закон сохранение массы веществ в химических реакциях. Следствием из этого закона стало: 1) Подтверждение основы материалистического
- 28. 1. Что изучает химия? Зачем? 2. Что такое вещества? Из чего образованы вещества? 3. Что такое
- 29. Упр. №1 Пользуясь алгоритмом определите валентности элементов.
- 30. №2 Пользуясь алгоритмом составьте формулы по валентности.
- 32. Скачать презентацию






















 Lesson 2 and 3. The chemistry of life
Lesson 2 and 3. The chemistry of life Современные тенденции развития химии
Современные тенденции развития химии Растворы неэлектролитов и электролитов
Растворы неэлектролитов и электролитов Неметаллические конструкционные материалы
Неметаллические конструкционные материалы Коррозия и методы борьбы с ней
Коррозия и методы борьбы с ней Соляные породы
Соляные породы Химические элементы IV группы главной подгруппы
Химические элементы IV группы главной подгруппы Фенолы
Фенолы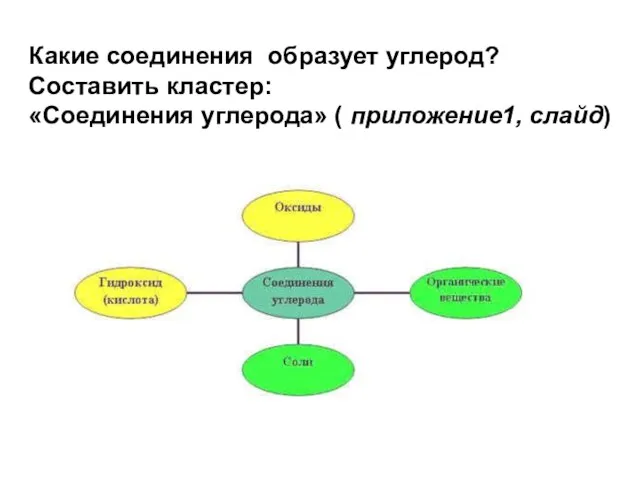 Угольная кислота и её соли
Угольная кислота и её соли Вода. Анализ и синтез. Состав оснований
Вода. Анализ и синтез. Состав оснований Инертные газы
Инертные газы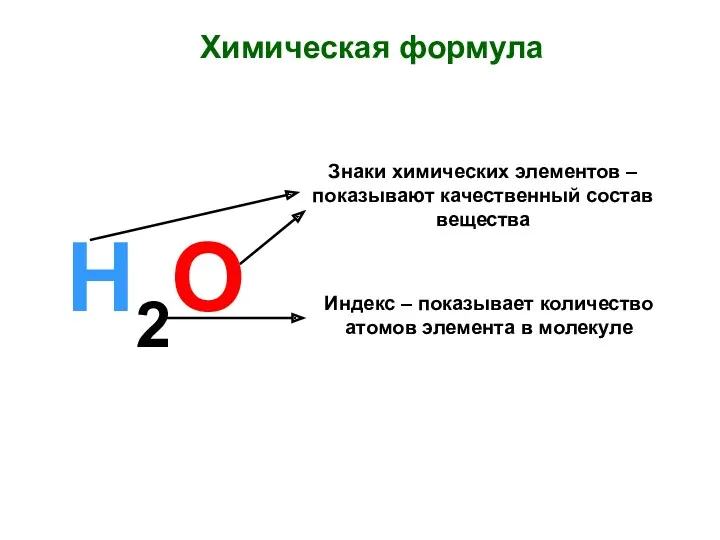 Химическая формула. Знаки химических элементов
Химическая формула. Знаки химических элементов Развивающие занятия в ГПД Поделочные камни
Развивающие занятия в ГПД Поделочные камни Свойства топлив. Марки бензинов и их характеристики
Свойства топлив. Марки бензинов и их характеристики Періодична система хімічних елементів. Хімія. 8 клас
Періодична система хімічних елементів. Хімія. 8 клас Обмен липидов
Обмен липидов Крохмаль. Структурна формула крохмалю
Крохмаль. Структурна формула крохмалю Индикаторные ошибки кислотно-основного титрования
Индикаторные ошибки кислотно-основного титрования Галогены. Положение в ПСХЭ Д.И. Менделеева
Галогены. Положение в ПСХЭ Д.И. Менделеева Вводные понятия к установке кристаллов
Вводные понятия к установке кристаллов Введение в органическую химию
Введение в органическую химию Химические свойства основных классов неорганических соединений
Химические свойства основных классов неорганических соединений Тотығу-тотықсыздану реакциялары. Тотығу және тотықсыздану
Тотығу-тотықсыздану реакциялары. Тотығу және тотықсыздану Горение вещества и способы его прекращения
Горение вещества и способы его прекращения Химическое образование в современной средней (полной) общеобразовательной школе
Химическое образование в современной средней (полной) общеобразовательной школе Гидролиз органических и неорганических соединений
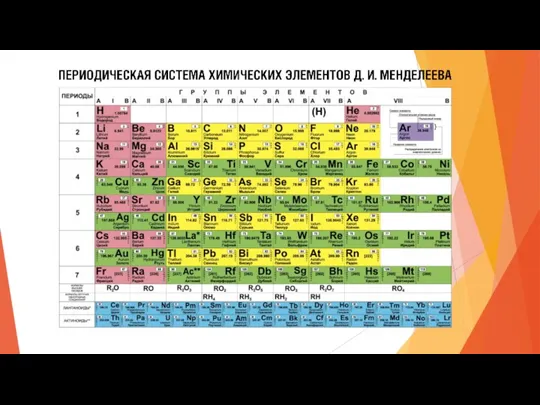
Гидролиз органических и неорганических соединений Периодический закон и периодическая система химических элементов Д. И. Менделеева
Периодический закон и периодическая система химических элементов Д. И. Менделеева Общая электронная теория восстановления и окисления металлов
Общая электронная теория восстановления и окисления металлов