Слайд 2

План лекции
1. Агрегатные состояния вещества.
2. Свойства разбавленных растворов. Осмос. Кипение и
замерзание растворов.
3.Теория электролитической диссоциации.
4. Сильные и слабые электролиты.
5.Равновесие в растворах слабых электролитов.
6. Значение электролитов для живых организмов.
Слайд 3
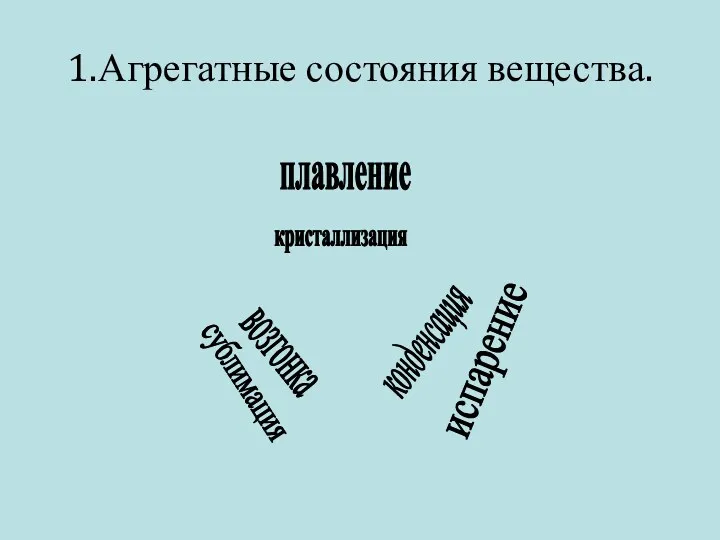
1.Агрегатные состояния вещества.
плавление
кристаллизация
испарение
конденсация
возгонка
сублимация
Слайд 4

2.Осмос.
Осмос – это односторонняя диффузия молекул растворителя через полупроницаемую мембрану из
растворителя в раствор или из разбавленного раствора в концентрированный раствор.
Осмотическое давление – это давление молекул растворителя на полупроницаемую мембрану.
Закон Вант-Гоффа:
Росм. неэл.= СмRT
См – молярная концентрация, моль/л, R - универсальная газовая постоянная 8,31 Дж/моль·К, Т – температура, К.
Слайд 5

Кипение и замерзание растворов неэлектролитов
Δ t кип. - повышение температуры
кипения раствора
Δ t кип. = t кип. р-ра - t кип. р-ля
1 закон Рауля:
Δ t кип. = ЕСm
Е- эбуллиоскопическая постоянная,
Сm –моляльная концентрация, моль/кг р-ля
Δ t зам.- понижение температуры замерзания раствора
Δ t зам.= Δ t зам. р-ля - Δ t зам.р-ра
2 закон Рауля:
Δ t зам. = КСm
К- криоскопическая постоянная,
Сm –моляльная концентрация, моль/кг р-ля
Слайд 6

Свойства растворов электролитов.
i- изотонический коэффициент показывает меру отклонения поведения растворов электролитов
от неэлектролитов. ( i эл.>1).
Закон Вант-Гоффа для растворов электролитов:
Росм. эл. = i СмRT
См – молярная концентрация, моль/л
Законы Рауля для растворов электролитов:
Δ t кип. эл. = i ЕСm
Δ t зам. эл. = i КСm
Сm- моляльная концентрация, моль/кг р-ля
Слайд 7

3.Теория электролитической диссоциации
Аррениуса (ТЭД)
Электролиты- это вещества, растворы или расплавы которых проводят
электрический ток.
Неэлектролиты -это вещества, растворы или расплавы которых не проводят электрический ток.
ТЭД Аррениуса(1887 г.)
1. Молекулы электролитов при растворении или плавлении распадаются на ионы.
2. При пропускании электрического тока через раствор или расплав электролита положительные ионы движутся к катоду (это катионы), а отрицательные – к аноду (это анионы).
3. Диссоциация –процесс обратимый.
Слайд 8

4. Сильные и слабые электролиты.
α- степень диссоциации электролита:
α= n/N·100%
n –число молекул,
распавшихся на ионы
N – общее число молекул в растворе.
Сильные электролиты в водных растворах полностью диссоциируют на ионы.
α каж. – кажущуюся степень диссоциации электролита.
α каж. > 30% у сильных электролитов,
α каж. < 3% у слабых электролитов,
3% < α каж. < 30% у электролитов средней силы.
Слайд 9

Константа диссоциации слабых электролитов
Слабые электролиты диссоциируют обратимо и ступенчато. В их
растворах устанавливается динамическое равновесие.
Константа химического равновесия для диссоциации слабых электролитов называется константа диссоциации (Кд.).
Кд. характеризует способность электролита диссоциировать на ионы. Чем меньше Кд. , тем слабее электролит диссоциирует на ионы.
Пример:
Слайд 10

5.Равновесие в растворах слабых электролитов.
Влияние одноименного иона на диссоциацию слабого электролита.
Пример. Что произойдет с диссоциацией HF при добавлении NaF?
Ответ: При добавлении NaF в растворе увеличится концентрация фторид - ионов и химическое равновесие в растворе HF сместится влево. Диссоциация HF уменьшится.
Вывод: одноименный ион уменьшает диссоциацию слабого электролита.
Слайд 11

Влияние связывающего иона на диссоциацию слабого электролита.
Пример. Что произойдет с
диссоциацией HF при добавлении КОН?
Ответ: При добавлении КОН в растворе уменьшится концентрация ионов водорода Н+ они свяжутся : (Н+ + ОН- → Н2О) и химическое равновесие в растворе HF сместится вправо. Диссоциация HFувеличится.
Вывод: связывающий ион увеличивает диссоциацию слабого электролита.
Слайд 12

Способы выражения концентрации растворов
1. Массовая доля, С, % - показывает сколько
граммов растворенного вещества содержится в 100 г раствора
2. Молярная концентрация, ,М, моль/л – показывает сколько моль растворенного в-ва содержится в 1 л раствора
Слайд 13
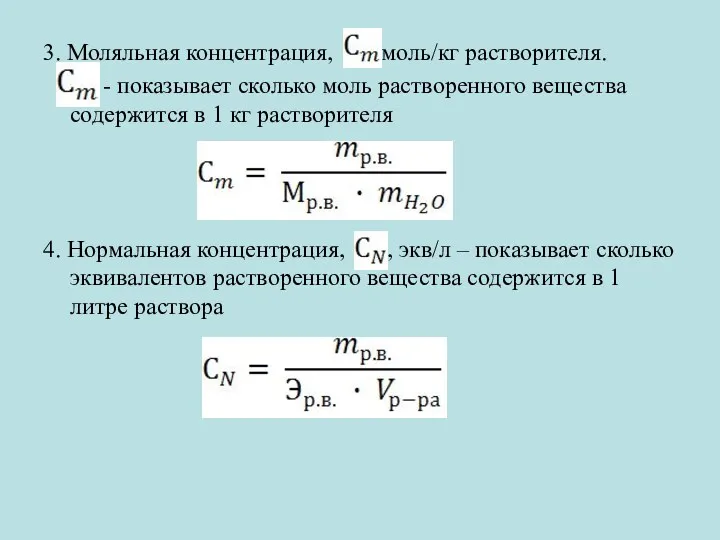
3. Моляльная концентрация, , моль/кг растворителя.
- показывает сколько моль растворенного
вещества содержится в 1 кг растворителя
4. Нормальная концентрация, , экв/л – показывает сколько эквивалентов растворенного вещества содержится в 1 литре раствора
Слайд 14

5. Титр, Т, г/мл – показывает сколько граммов растворенного вещества содержится
в 1 мл раствора
6. Мольная доля, N, показывает отношение количества растворенного вещества к количеству всех компонентов раствора
Слайд 15

Значение растворов электролитов
для живых организмов
1. Электролиты – это составная часть
жидкостей и плотных тканей живых организмов.
2. Ионы
имеют большое значение для физиологических и биохимических процессов.
3. Ионы водорода способствуют нормальному функционированию ферментов, обмену веществ.
4. Физраствор – это 0,85%-ный раствор NaCl, который вводят внутривенно при обезвоживании организма.
5. Все биохимические реакции в организме протекают в растворах.














 Свойства кислот
Свойства кислот Состав, строение и свойства сырья для производства строительных материалов
Состав, строение и свойства сырья для производства строительных материалов кислоты
кислоты Мыло. Мылящие вещества в природе
Мыло. Мылящие вещества в природе Технология производства хлорбензола
Технология производства хлорбензола Практическая работа №1. Приготовление раствора с определенной массовой долей соли
Практическая работа №1. Приготовление раствора с определенной массовой долей соли Поверхневі явища в дисперсних системах. Поверхнева енергія
Поверхневі явища в дисперсних системах. Поверхнева енергія Развивающие занятия в ГПД Поделочные камни
Развивающие занятия в ГПД Поделочные камни Классификация химических реакций по механизму реакции
Классификация химических реакций по механизму реакции Азотная кислота и ее соли
Азотная кислота и ее соли Хімія металургійних процесів. Теорія сплавів
Хімія металургійних процесів. Теорія сплавів Кислород. Открытие кислорода
Кислород. Открытие кислорода Комплексные соединения
Комплексные соединения Электролитическая диссоциация. 9 класс
Электролитическая диссоциация. 9 класс Алкалоиды и принципы их классификации
Алкалоиды и принципы их классификации Темір және оның маңызды қосылыстары
Темір және оның маңызды қосылыстары Фолий қышқылы (B9 дәрумені)
Фолий қышқылы (B9 дәрумені) Распространение водорода в природе. Получение в лаболатории
Распространение водорода в природе. Получение в лаболатории Крахмал. Физические свойства
Крахмал. Физические свойства Тепловой эффект химических реакций
Тепловой эффект химических реакций Водород. Свойства водорода
Водород. Свойства водорода Строение атома. Химия. 11 класс
Строение атома. Химия. 11 класс Кремний и его соединения. К уроку химии в 9 классе
Кремний и его соединения. К уроку химии в 9 классе Колдовство волшебницы ОВ: окислительные или восстановительные превращения
Колдовство волшебницы ОВ: окислительные или восстановительные превращения Типичные реакции органических соединений
Типичные реакции органических соединений Вуглеводи. Лекція
Вуглеводи. Лекція Химические свойства легкоплавких металлов
Химические свойства легкоплавких металлов Твердые тела и их физические свойства
Твердые тела и их физические свойства