Содержание
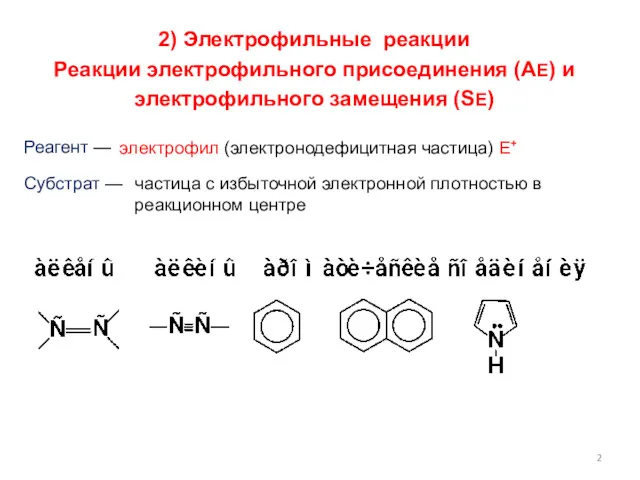
- 2. 2) Электрофильные реакции Реакции электрофильного присоединения (АЕ) и электрофильного замещения (SE) Реагент — Субстрат — электрофил
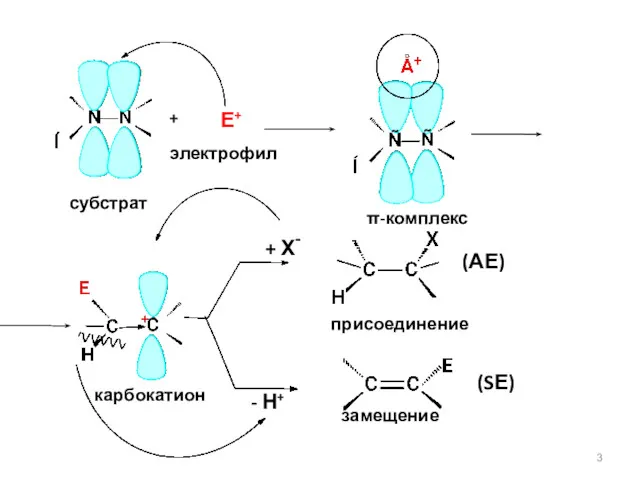
- 3. карбокатион + Е+ электрофил π-комплекс субстрат + Х- - Н+ (АЕ) присоединение (SЕ) замещение
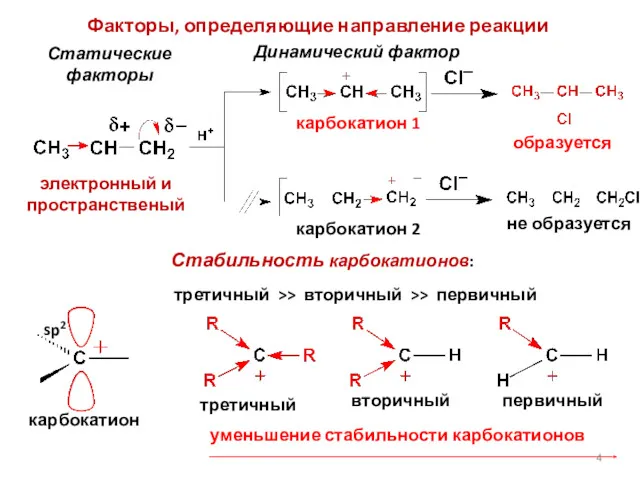
- 4. электронный и пространственый Статические факторы Динамический фактор Стабильность карбокатионов: Факторы, определяющие направление реакции карбокатион 1 образуется
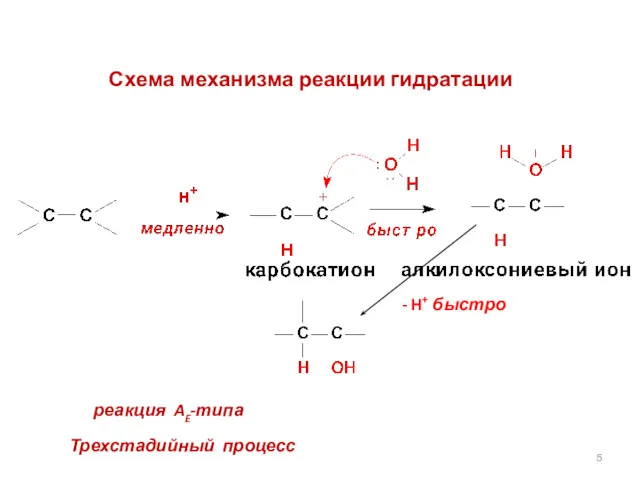
- 5. Схема механизма реакции гидратации Трехстадийный процесс реакция AE-типа - H+ быстро
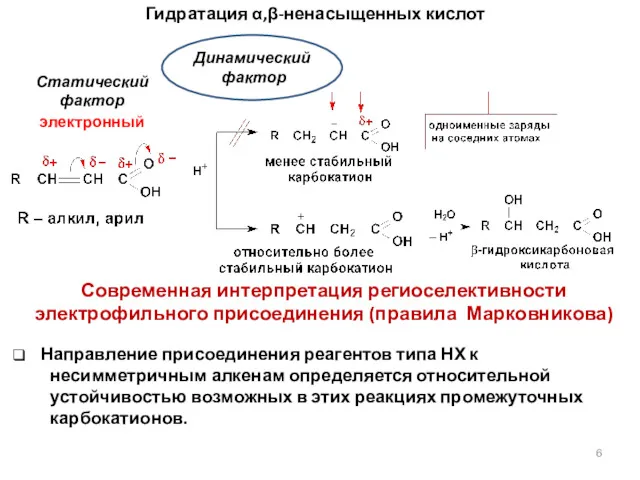
- 6. Статический фактор электронный Направление присоединения реагентов типа НХ к несимметричным алкенам определяется относительной устойчивостью возможных в
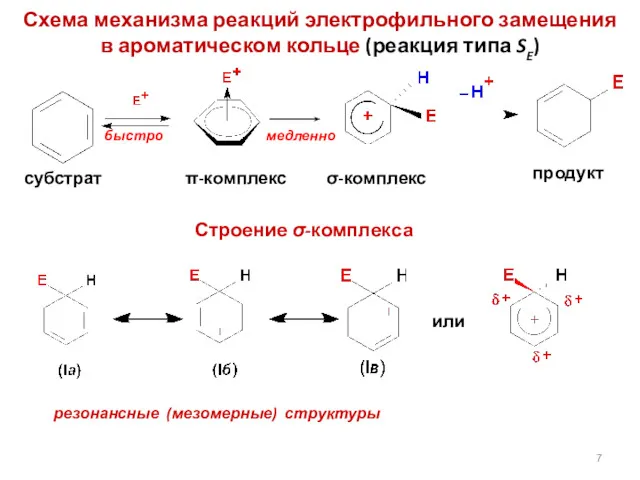
- 7. Схема механизма реакций электрофильного замещения в ароматическом кольце (реакция типа SE) Строение σ-комплекса резонансные (мезомерные) структуры
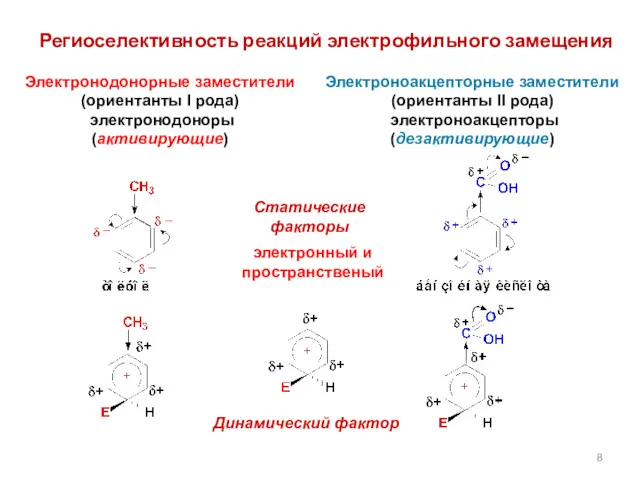
- 8. Региоселективность реакций электрофильного замещения Электроноакцепторные заместители (ориентанты II рода) электроноакцепторы (дезактивирующие) Статические факторы электронный и пространственый
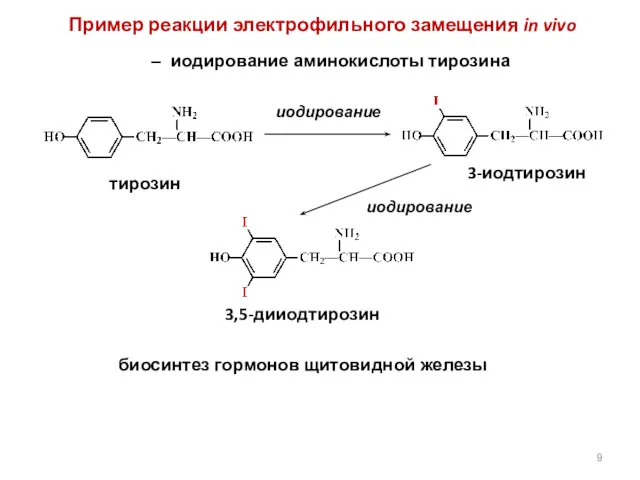
- 9. Пример реакции электрофильного замещения in vivo – иодирование аминокислоты тирозина тирозин 3-иодтирозин 3,5-дииодтирозин иодирование иодирование биосинтез
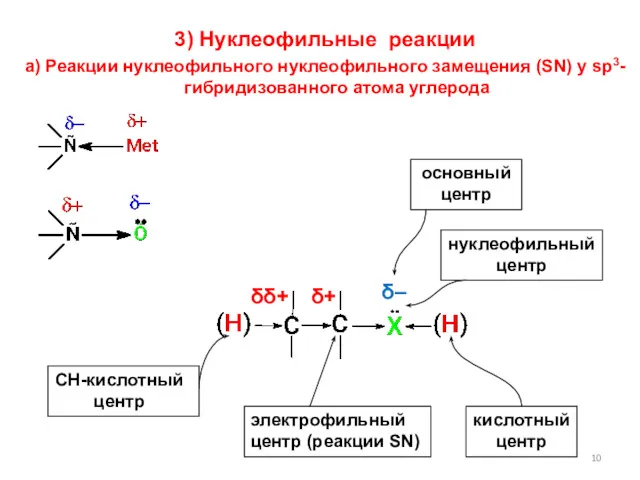
- 10. 3) Нуклеофильные реакции а) Реакции нуклеофильного нуклеофильного замещения (SN) у sp3-гибридизованного атома углерода δ– δ+ δδ+
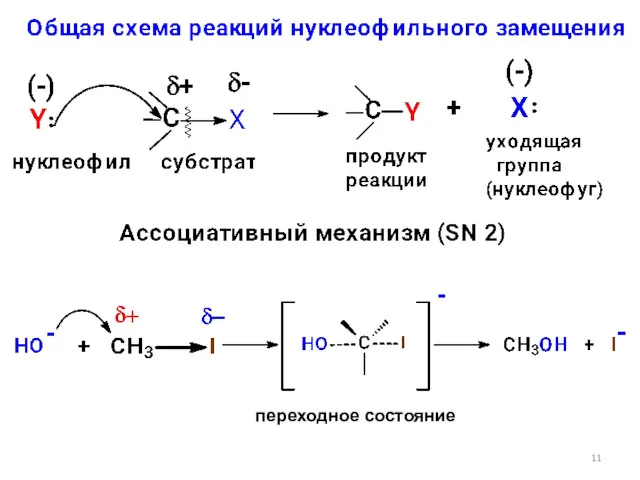
- 11. переходное состояние
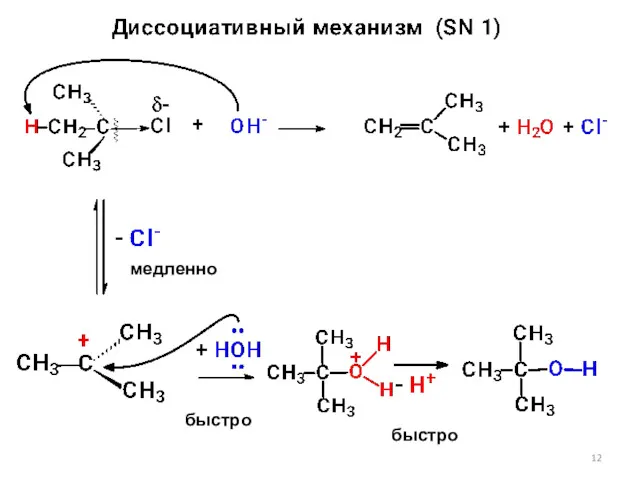
- 12. медленно быстро быстро
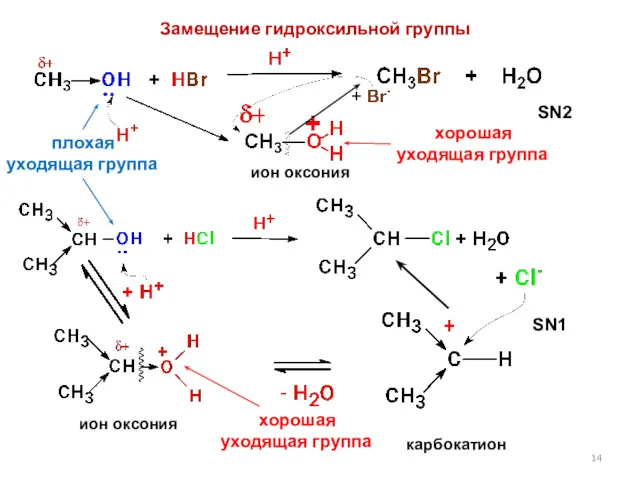
- 13. Концепция хороших и плохих уходящих групп Чем сильнее кислота, сопряженная уходящей группе в реакции нуклеофильного замещения,
- 14. ион оксония ион оксония карбокатион SN1 плохая уходящая группа хорошая уходящая группа SN2 хорошая уходящая группа
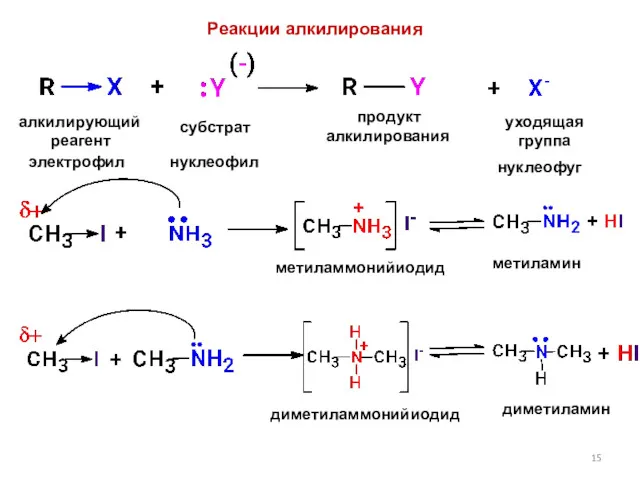
- 15. алкилирующий реагент субстрат продукт алкилирования уходящая группа электрофил нуклеофил нуклеофуг метиламмонийиодид метиламин диметиламмонийиодид диметиламин Реакции алкилирования
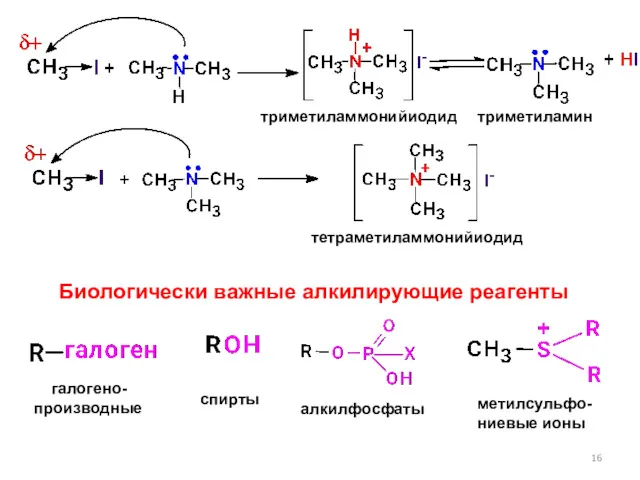
- 16. триметиламмонийиодид триметиламин тетраметиламмонийиодид Биологически важные алкилирующие реагенты галогено- производные спирты алкилфосфаты метилсульфо- ниевые ионы
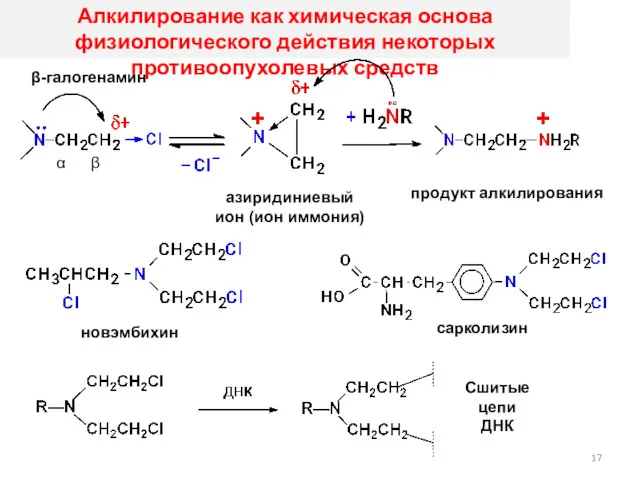
- 17. Алкилирование как химическая основа физиологического действия некоторых противоопухолевых средств β-галогенамин α β азиридиниевый ион (ион иммония)
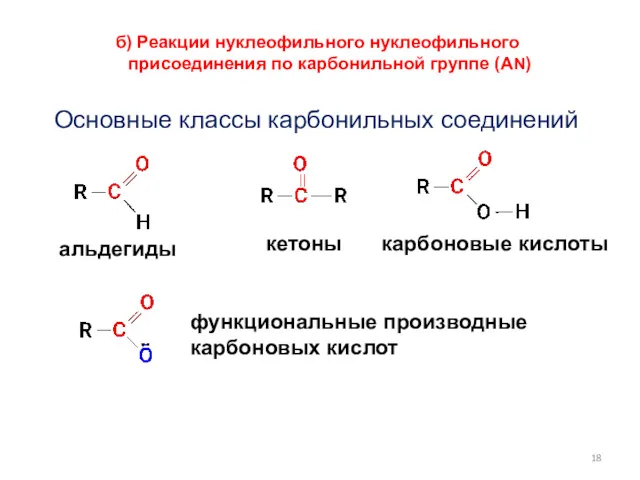
- 18. б) Реакции нуклеофильного нуклеофильного присоединения по карбонильной группе (АN) Основные классы карбонильных соединений альдегиды кетоны карбоновые
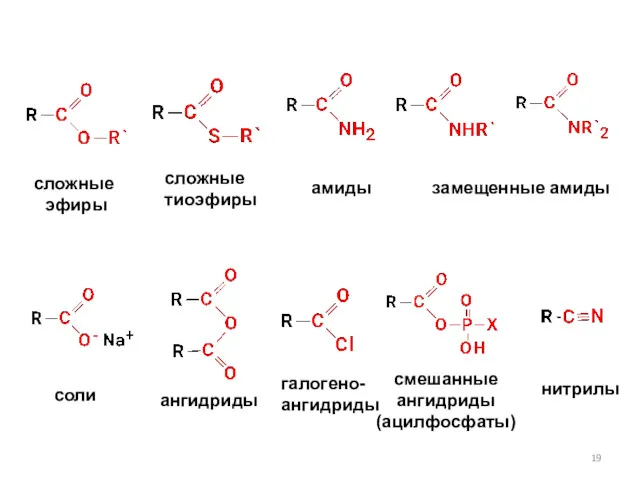
- 19. сложные эфиры сложные тиоэфиры амиды замещенные амиды соли ангидриды галогено- ангидриды смешанные ангидриды (ацилфосфаты) нитрилы
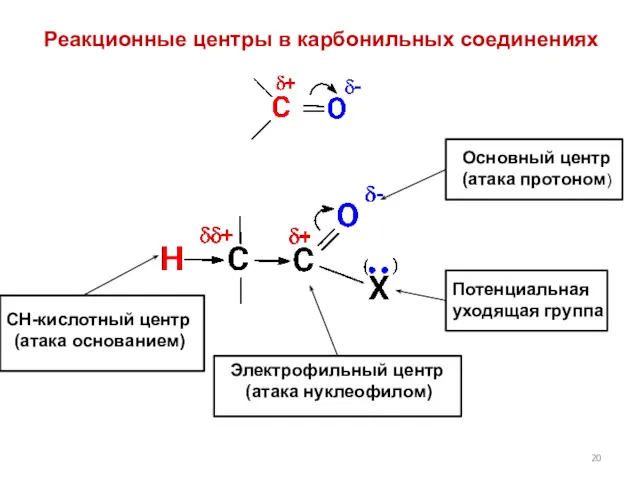
- 20. Реакционные центры в карбонильных соединениях СН-кислотный центр (атака основанием) Электрофильный центр (атака нуклеофилом) Основный центр (атака
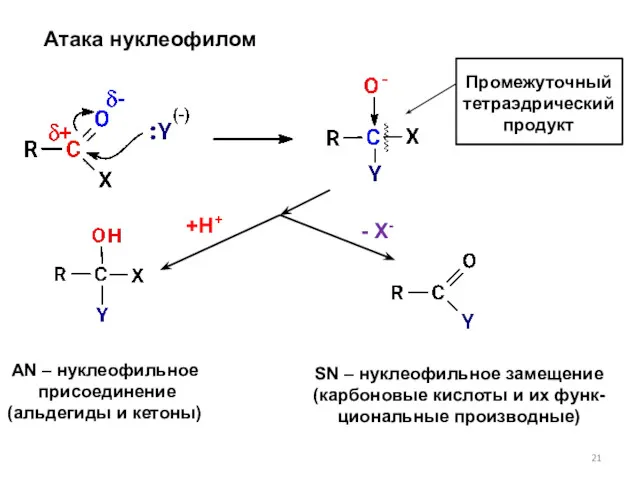
- 21. Атака нуклеофилом Промежуточный тетраэдрический продукт +Н+ - X- AN – нуклеофильное присоединение (альдегиды и кетоны) SN
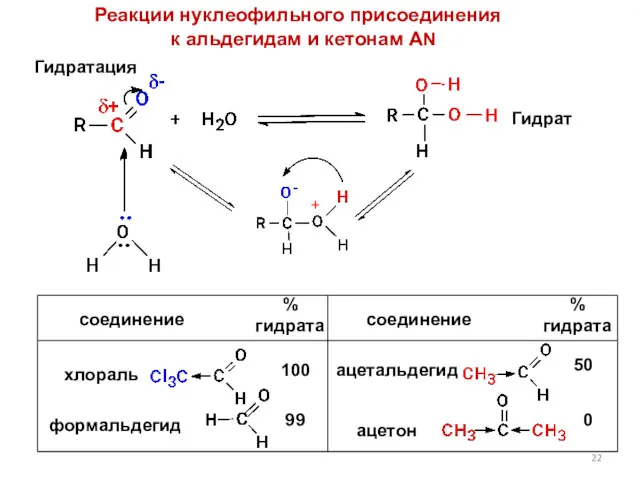
- 22. Реакции нуклеофильного присоединения к альдегидам и кетонам AN Гидратация Гидрат 100 99 50 0 + соединение
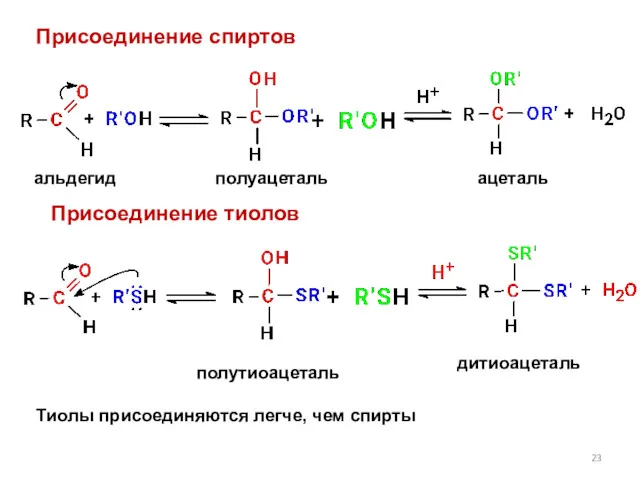
- 23. Присоединение спиртов полуацеталь ацеталь альдегид Присоединение тиолов полутиоацеталь дитиоацеталь Тиолы присоединяются легче, чем спирты
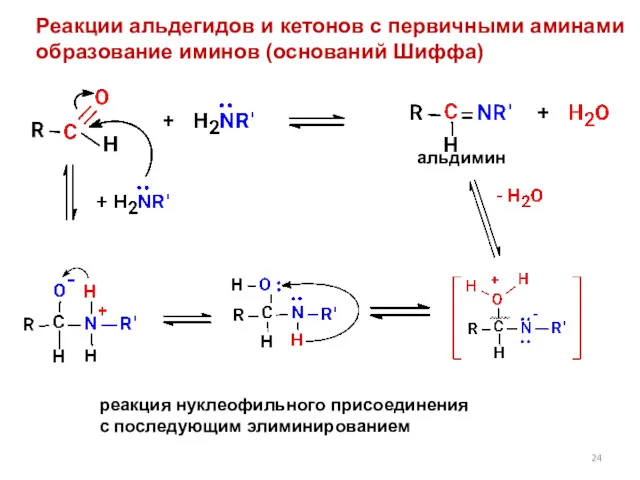
- 24. Реакции альдегидов и кетонов с первичными аминами образование иминов (оснований Шиффа) реакция нуклеофильного присоединения с последующим
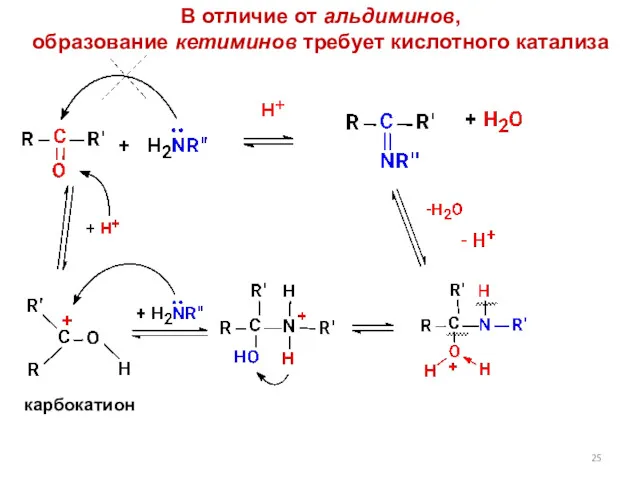
- 25. В отличие от альдиминов, образование кетиминов требует кислотного катализа карбокатион
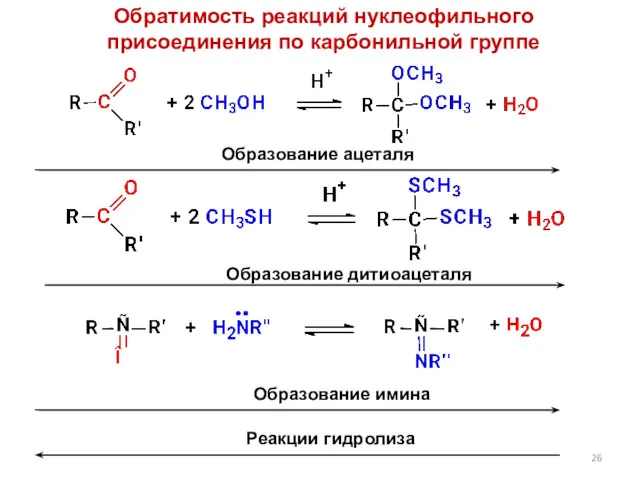
- 26. Обратимость реакций нуклеофильного присоединения по карбонильной группе Образование ацеталя Образование дитиоацеталя Образование имина Реакции гидролиза
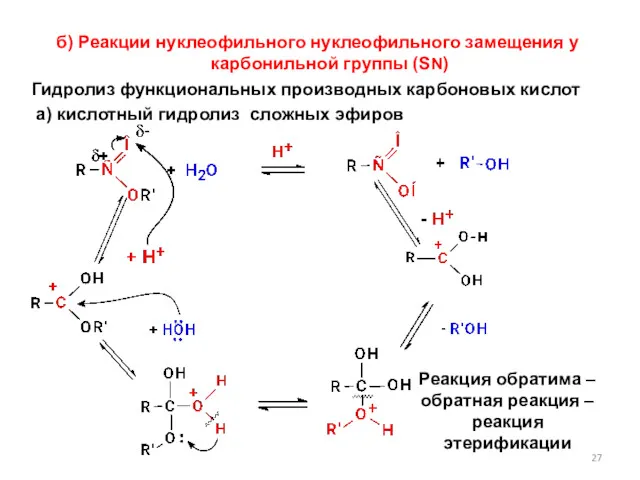
- 27. б) Реакции нуклеофильного нуклеофильного замещения у карбонильной группы (SN) Гидролиз функциональных производных карбоновых кислот а) кислотный
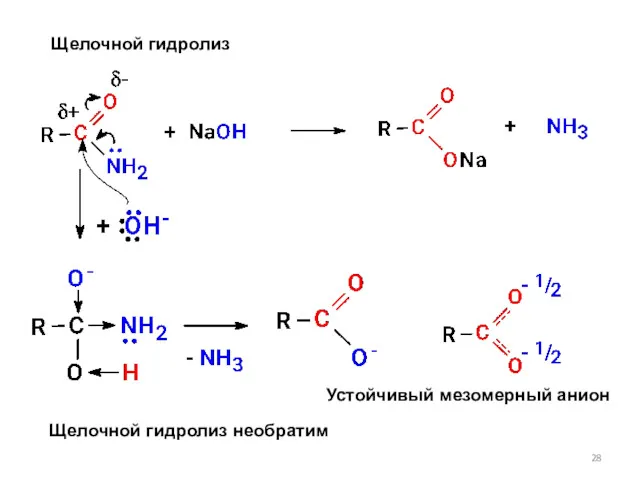
- 28. Щелочной гидролиз Щелочной гидролиз необратим Устойчивый мезомерный анион
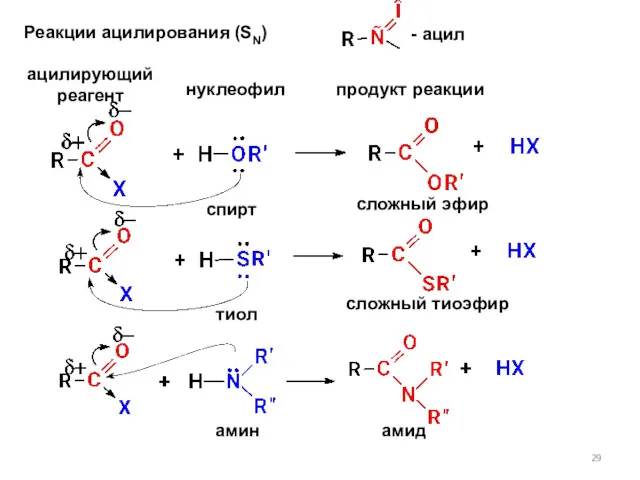
- 29. Реакции ацилирования (SN) ацилирующий реагент нуклеофил продукт реакции спирт сложный эфир - ацил тиол сложный тиоэфир
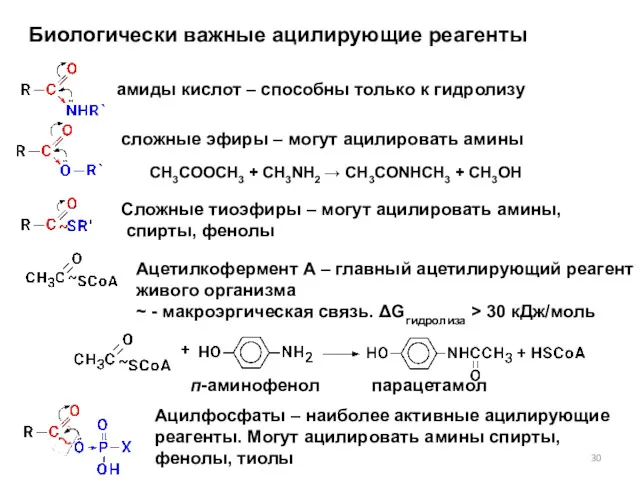
- 30. Биологически важные ацилирующие реагенты амиды кислот – способны только к гидролизу сложные эфиры – могут ацилировать
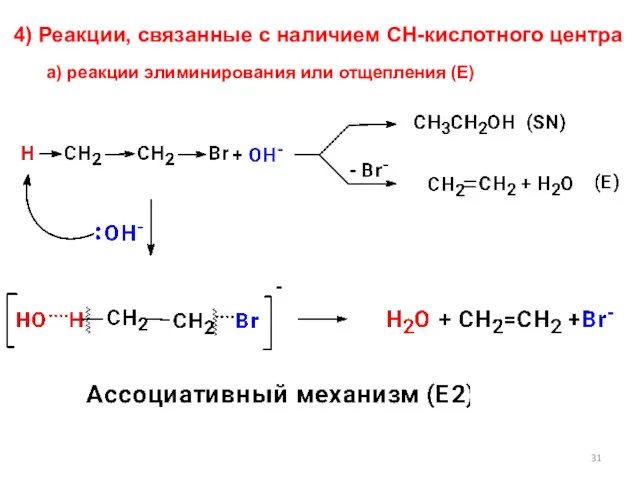
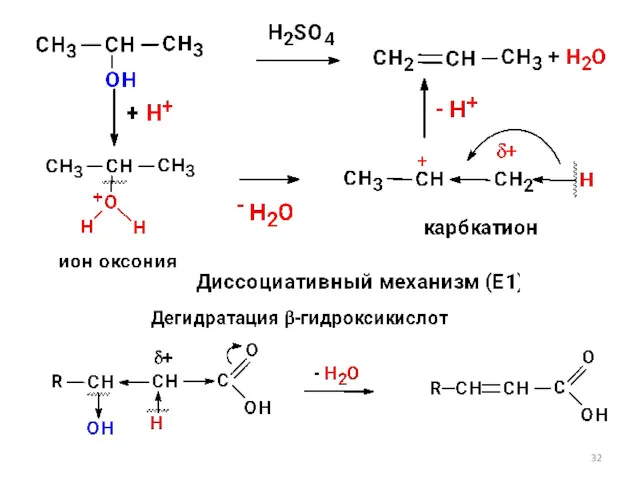
- 31. 4) Реакции, связанные с наличием СН-кислотного центра а) реакции элиминирования или отщепления (Е)
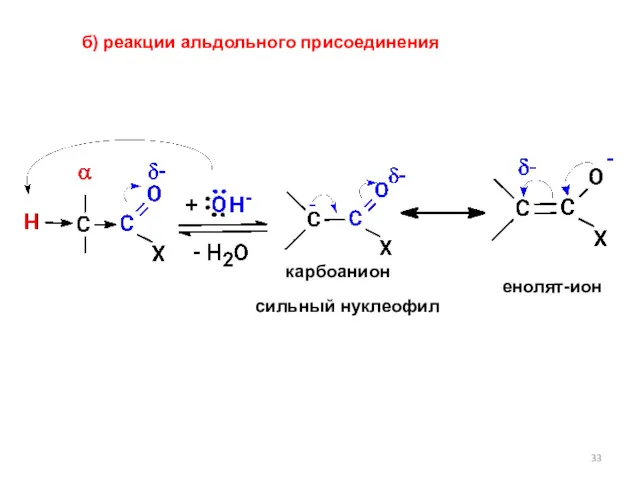
- 33. б) реакции альдольного присоединения енолят-ион карбоанион сильный нуклеофил
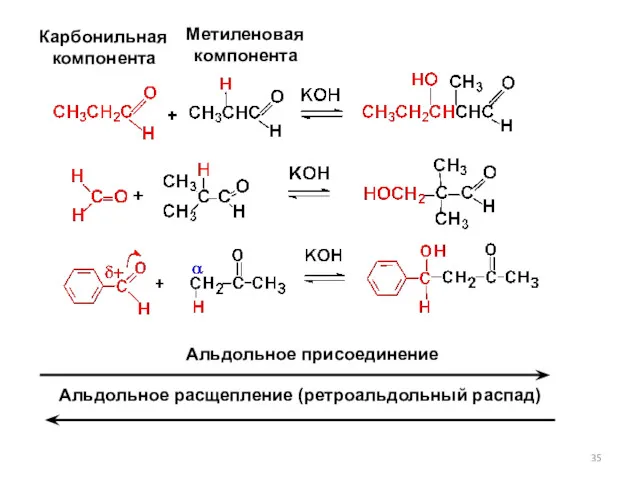
- 34. основание альдоль карбонильная компонента метиленовая компонента (карбанион) алкоксид-ион (сильное основание)
- 35. Карбонильная компонента Метиленовая компонента Альдольное присоединение Альдольное расщепление (ретроальдольный распад)
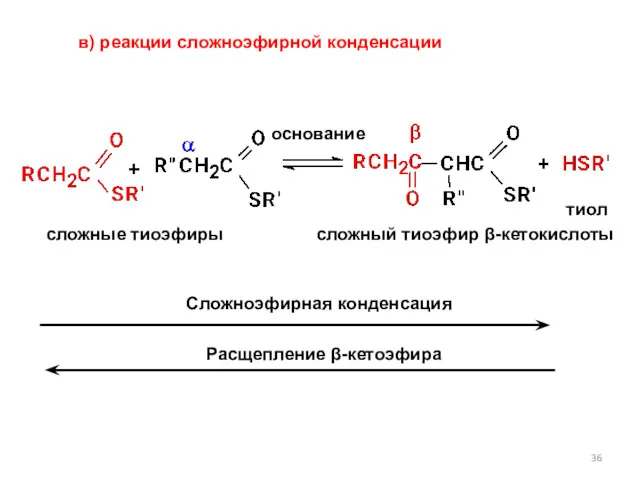
- 36. основание сложные тиоэфиры сложный тиоэфир β-кетокислоты тиол Сложноэфирная конденсация Расщепление β-кетоэфира в) реакции сложноэфирной конденсации
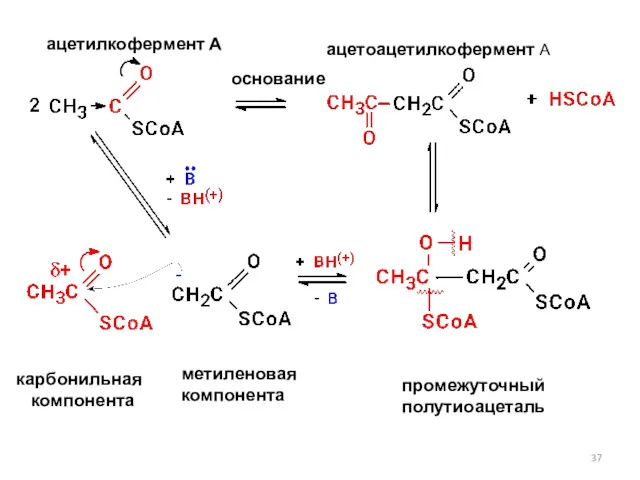
- 37. основание ацетилкофермент А ацетоацетилкофермент А карбонильная компонента метиленовая компонента промежуточный полутиоацеталь
- 39. Скачать презентацию


 Теория химического строения органических соединений
Теория химического строения органических соединений Plastic is one of the challenges of the 21st century
Plastic is one of the challenges of the 21st century Непредельные углеводороды ряда этилена. Олефины
Непредельные углеводороды ряда этилена. Олефины Почвенный раствор. Химический состав почвенных растворов. Водный режим почв. Кислотность и щелочность почвенных растворов
Почвенный раствор. Химический состав почвенных растворов. Водный режим почв. Кислотность и щелочность почвенных растворов Фазовые равновесия в растворах
Фазовые равновесия в растворах Сера. Аллотропные модификации
Сера. Аллотропные модификации Carbohydrates and their metabolism. Digestion of carbohydrates
Carbohydrates and their metabolism. Digestion of carbohydrates Правила работы в лаборатории и приёмы обращения с лабораторным оборудованием (8 класс)
Правила работы в лаборатории и приёмы обращения с лабораторным оборудованием (8 класс) Химическая связь
Химическая связь Термическая и химико-термическая обработка
Термическая и химико-термическая обработка Обчислення за хімічними рівняннями відносного виходу продукту реакції. Урок №19. 11 клас
Обчислення за хімічними рівняннями відносного виходу продукту реакції. Урок №19. 11 клас Методические подходы к решению химических задач. Задание 34
Методические подходы к решению химических задач. Задание 34 Методика обучения решению задач на соотношение атомов в школьном курсе химии
Методика обучения решению задач на соотношение атомов в школьном курсе химии Химические уравнения
Химические уравнения Аммиак
Аммиак Техника безопасности в кабинете химии
Техника безопасности в кабинете химии Виды камней
Виды камней Альдегиды, свойства, получение, применение
Альдегиды, свойства, получение, применение Соли. 11 класс
Соли. 11 класс CaSO4 кристаллының ас жазықтығына проекциясының құрылымдық моделі
CaSO4 кристаллының ас жазықтығына проекциясының құрылымдық моделі Обмен жиров в организме
Обмен жиров в организме Введение в органическую химию
Введение в органическую химию Фосфор и его соединения. Урок по химии для 9 класса
Фосфор и его соединения. Урок по химии для 9 класса Электролиттік диссоциациялану теориясы тұрғысынан қышқыл, негіз, тұздардың химиялық қасиеттері
Электролиттік диссоциациялану теориясы тұрғысынан қышқыл, негіз, тұздардың химиялық қасиеттері Элементы группы галогенов
Элементы группы галогенов Кислород, его характеристика, получение и свойства
Кислород, его характеристика, получение и свойства Спирти. 3агальна характеристика спиртів
Спирти. 3агальна характеристика спиртів Щелочи
Щелочи