Слайд 2

С повышением заряда ядра в группе от F к At увеличиваются
радиусы атомов Это находит отражение в уменьшении-в ряду F —At энергии ионизации ЕИ
и сродства к электрону Ес, электроотрицательности ОЭО, стандартного потенциала восстановления Ох/Red элементных веществ Г2 обусловлено меньшим размером атома.
в ряду F — Cl — Br — I—-At окислительная акТИвность снижается.
Слайд 3

Элементные галогены (нулевая степень окисления) представляют собой двухатомные неполярные молекулы Г2.
Появление нечетных положительных степеней окисления +1, +3, +5, + 7 атомов Cl, Br, I, At связано с переходом электронов на d-орбитали.
Исключение составляет фтор. Отсутствие низколежащих d-подуровней у его атома приводит к тому, что процесс возбуждения оказывается невыгодным.
Слайд 4

Все галогены проявляют степень окисления — 1 в водород-галогенидах НГ (например,
HF, HC1) и в солях-галогенидах ЭГ (NaF, NaCl и др.).
Водородгалогениды (НГ) — газы, хорошо растворимые в воде. Водные растворы НГ ведут себя как кислоты. Сила кислот НГ растет с уменьшением электроотрицательности галогенов сверху вниз по группе. Такой характер изменения силы кислот НГ объясняется уменьшением прочности связи Н—Г в ряду HF — НС1 — HBr —HI и уменьшением энергии гидратации ионов Г-
Слайд 5

Молекулы галогенов двухатомные: F2, Cl2, Br2, J2.
Фтор и хлор –
газы, бром – летучая жидкость, иод – твердый, но он легко возгоняется.
Галогены являются сильными окислителями:
2Na+Cl2→2NaCl
2Р+5Cl2→2РCl5
S+Cl2→SCl2
2FeCl2+Cl2→2FeCl3
Na2SO3+Br2+H2O→Na2SO4+2HBr
H2S+J2→S↓+2HJ.
В ряду F-Cl-Br-J, по мере увеличения радиуса атомов, окислительная активность нейтральных атомов ослабевает.
Особенно выраженную химическую активность проявляет фтор, который при нагревании реагирует даже с некоторыми благородными газами: Хе+2F2→ХеF4.
.
Слайд 6

Химическая активность галогенов (и окислительная способность) уменьшается от фтора к иоду,
т.к. с увеличением радиуса атома способность галогенов присоединять электроны уменьшается: F2>Cl2>Br2>J2.
Фтор реагирует с водородом со взрывом даже в темноте.
Хлор без освещения не реагирует с водородом, но при нагревании или при ярком свете реакция протекает по цепному механизму. Бром с водородом взаимодействует только при нагревании, а йод – только при сильном нагревании, да и то не полностью, т.к. начинает идти обратная реакция разложения йодоводорода.
Более активный галоген всегда вытесняет менее активный из его соединений с металлами: Cl2+2KBr→Br2+2KCl,
Br2+2KJ→J2+2KBr
Слайд 7

галогеноводороды.
==Летучие водородные соединения галогенов хорошо растворимы в воде, вследствие полярности
их молекул.
==В водных растворах они ведут себя как кислоты. Сила кислот уменьшается от HJ к HF, т.к. прочность химической связи в молекулах галогеноводородов падает в ряду
HF-HCl-HBr-HJ,
вследствие увеличения радиуса и поляризуемости анионов от F- до J-.
Анионы галогенов (кроме фтора) способны отдавать электроны, поэтому они являются восстановителями. Восстановительная способность галогенид – анионов по мере возрастания их радиуса увеличивается: Cl-Характерная особенность фтороводородной кислоты – ее способность взаимодействовать с диоксидом кремния: SiO2+4HF→SiF4↑+2H2O.
Слайд 8

Анионы галогенов склонны к комплексообразованию в качестве лигандов.
Устойчивость галогенидных комплексов
обычно уменьшается в ряду F->Cl->Br-->J-. Именно процессом комплексообразования объясняется токсическое действие фторид-ионов, которые, образуя фторидные комплексы с катионами металлов, входящих в активные центры ферментов, подавляют их активность.
Известны комплексы, где комплексообразователем является галогенид-ион, а лигандами – молекулы галогенов. Так, растворимость молекулярного иода в воде резко возрастает в присутствии иодида калия, что связано с образованием комплексного аниона:
J-+J2↔[J(J2)]-.
Диссоциация комплекса обеспечивает присутствие в растворе молекулярного иода, обладающего бактерицидными свойствами. Поэтому в медицинской практике используют раствор иода с добавлением KJ.
Слайд 9

Из кислородсодержащих соединений наиболее устойчивы соли кислородных кислот, наименее – оксиды
и кислоты.
Во всех кислородсодержащих соединениях галогены, кроме фтора, проявляют положительную степень окисления от +1 до +7.
Фторид кислорода получают пропусканием фтора через 2% раствор NaOH:
2F2+2NaOH→2NaF+H2O+OF2.
Фтор окисляет воду:
2F2+H2O(ж)→OF2+2HF
2F2+2H2O(пар)→4HF+O2.
Кислородсодержащих кислот фтор не образует
Слайд 10

Наиболее многочисленны кислородные соединения хлора. При реакции хлора с водой образуется
хлорная вода, содержащая хлористый водород (соляную кислоту) и гипохлористую (хлорноватистую) кислоту:
Cl2+H2O↔HCl+HClO.
Реакция является обратимой, а ее равновесие сильно смещено влево. Гипохлористая кислота неустойчива и легко распадается, особенно на свету:
HClO↔HCl+O.
В результате хлорная вода содержит три окислителя: молекулярный хлор, гипохлористую кислоту и атомарный кислород.
Образующийся атомарный кислород обесцвечивает красители и убивает микробы, что объясняет отбеливающее и бактерицидное действие хлорной воды.
Кислота HСlO настолько слабая, что даже угольной кислотой вытесняется из растворов гипохлоритов:
NaClO+H2O+CO2→NaHCO3+HClO.
Слайд 11

HClO более сильный окислитель, чем газообразный хлор. Она реагирует с органическими
соединениями RH:
2RH+2HClO→ROH+RCl+HCl+H2O.
Гипохлористая кислота денатурирует белки, из которых состоят микроорганизмы:
R-CO-NH-R1+HClO→R-CO-NCl-R1+H2O.
.
При добавлении к хлорной воде щелочи равновесие смещается вправо:
Cl2+2KOH→KCl+KClO+H2O.
Полученный раствор смеси солей, называемый жавелевой водой, используется как отбеливающее и дезинфицирующее средство: KClO+CO2+H2O→KHCO3+HClO.
Слайд 12

Хлорную известь рассматривают как смешанную соль соляной и гипохлористой кислоты CaOCl2,
которой отвечает структурная формула:
Cl
Ca Ca(OH)2+Cl2→CaOCl2+H2O.
O-Cl
Во влажном воздухе хлорная известь постепенно выделяет гипохлористую кислоту, которая обеспечивает ее отбеливающее, дезинфицирующее и дегазирующие свойства:
2CaОCl2+2CO2+2H2O→CaCl2+Ca(HCO3)2+2HClO.
При действии на хлорную известь соляной кислоты происходит выделение свободного хлора: CaOCl2+2HCl→CaCl2+H2O.
Кислота HClO2 называется хлористой, а ее соли – хлориты. Получают ее действием серной кислоты на хлорит бария:
Ba(ClO2)2+H2SO4→2HClO2+BaSO4↓.
Слайд 13

При нагревании гипохлористая кислота разлагается с образованием соляной и хлорноватой кислот:
3HClO→2HCl+HClO3.
При пропускании хлора через горячий раствор щелочи образуются хлорид калия и хлорат калия KClO3 (бертолетова соль):
6KOH+3Cl2→5KCl+KClO3+3H2O.
Хлорную кислоту получают действием H2SO4(конц.) на перхлорат калия:
KClO4+H2SO4→HClO4+KHSO4.
Слайд 14

По мере увеличения степени окисления хлора в ряду HClO-HClO2-HClO3-HClO4, сила кислот
увеличивается.
Сравнение окислительных свойств кислородных кислот хлора показывает, что в ряду анионов ClO- -ClO2- -ClO3- -ClO4- уменьшается окислительная способность
Слайд 15
![Хлор, фтор, бром, йод Cl — макроэлемент [0,15%], остальные —](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/409001/slide-14.jpg)
Хлор, фтор, бром, йод
Cl — макроэлемент [0,15%], остальные — микроэлементы [10–5%].
Фтор
В организме фтора 7 мг. Больше всего фтора в эмали — около 0,01% [труднорастворимый фторапатит Са5[РО4]3F]:
Са5[РО4]3ОН + F– ⮀ Са5[РО4]3F + OH–
ускоряя процесс реминерализации [образования кристаллов]:
10Са 2+ + 6РО4 3– + 2F– = 3Са3[РО4]2∙СаF2
Для питьевой воды добавляют NaF до нормы [1 мг/л]. Недостаток F приводит к кариесу.
Если содержание F будет выше 1,2 мг/л,, кости деформируются [развивается флюороз].
Механизм токсического действия фтора — образование комплексных соединений с кальцием, магнием и другими элементами — активаторами ферментов, вследствие чего фтор угнетает активность ряда ферментов.
Избыток фтора угнетает функцию щитовидной железы, т.к. фтор — конкурент йода в синтезе гормонов щитовидной железы.
Слайд 16

Хлор
В организме человека ≈100 г хлора.
Хлорид-ионы активируют ферменты [амилаза слюны], создают
благоприятную среду для действия протеолитических ферментов желудочного сока, обеспечивают ионные потоки через клеточные мембраны, участвуют в поддержании осмотического равновесия. Суточная потребность в NaCl составляет 5–10 г.
NaCl необходим для выработки НСl в желудке. НСl, помимо участия в пищеварении, уничтожает бактерии холеры, брюшного тифа.
Элементарный хлор — высокотоксичный газ.
Слайд 17
![Бром В организме всего 7 мг [10–5%]. Локализуется в железах](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/409001/slide-16.jpg)
Бром
В организме всего 7 мг [10–5%]. Локализуется в железах внутренней секреции
[в гипофизе]. Роль Br не ясна. Наиболее чувствительна к Br ЦНС. Бромид-ионы накапливаются в отделах мозга и действуют успокаивающе при повышенной возбудимости. Восстанавливается равновесие между процессами возбуждения и торможения.
Br– может замещать Cl– и I–, он выводится очень медленно. И хотя токсичность его невелика, но накопление может вызвать отравление — «бромизм».
Слайд 18
![Бром В организме всего 7 мг [10–5%]. Локализуется в железах](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/409001/slide-17.jpg)
Бром
В организме всего 7 мг [10–5%]. Локализуется в железах внутренней секреции
[в гипофизе]. Роль Br не ясна. Наиболее чувствительна к Br ЦНС. Бромид-ионы накапливаются в отделах мозга и действуют успокаивающе при повышенной возбудимости. Восстанавливается равновесие между процессами возбуждения и торможения.
Br– может замещать Cl– и I–, он выводится очень медленно. И хотя токсичность его невелика, но накопление может вызвать отравление — «бромизм».
Слайд 19

Йод
Незаменимый биогенный элемент. В организме 25 мг I В основном он
связан в виде гормонов и только 1% — в виде йодид-иона.
Щитовидная железа секретирует гормоны тироксин и трийодтиронин, которые влияют на обмен веществ, теплообразование, поглощение кислорода.
Гипотиреоз может быть связан: а/ с уменьшением способности связывать и накапливать йодид-ионы; б/ с недостатком в пище йода [эндемический зоб].
KI применяют и при гипо-, и при гипертиреозе. При эндемическом зобе йодид-ионы используются для синтеза гормонов, при гипертиреозе йодид-ионы тормозят йодирование тирозина йодом.
5% спиртовой раствор I2 — антисептическое средство.
Раствор йода в йодистом калии [раствор Люголя] применяется для смазывания слизистой оболочки гортани.
Радиоактивный изотоп йода 131I применяется для диагностических целей при нарушениях работы щитовидной железы, для диагностики опухолей мозга.
Йодиды окисляются кислородом при обычном освещении:
hν
2KI + 1/2O2 + H2O → I2 + 2KOH
Слайд 20
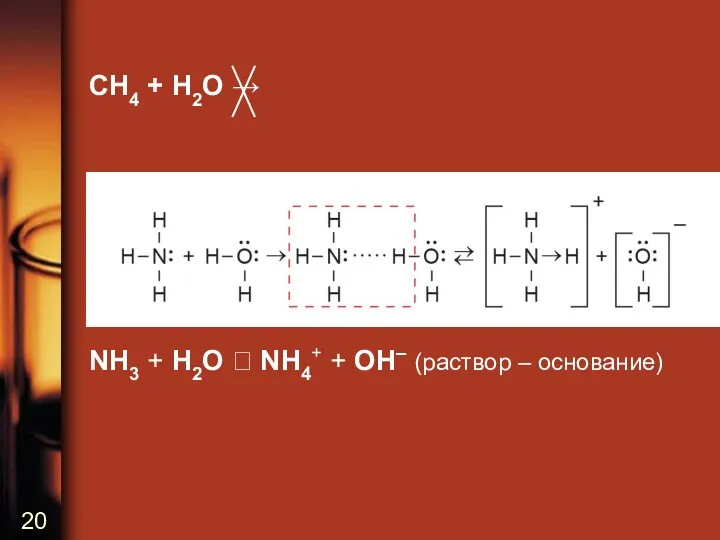
CH4 + H2O →
NH3 + H2O NH4+ + OH– (раствор
– основание)
Слайд 21
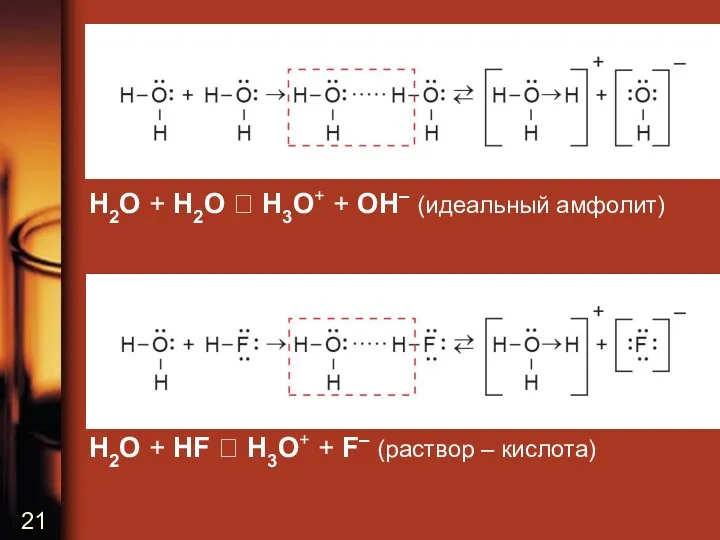
H2O + H2O H3O+ + OH– (идеальный амфолит)
H2O + HF
H3O+ + F– (раствор – кислота)
Слайд 22
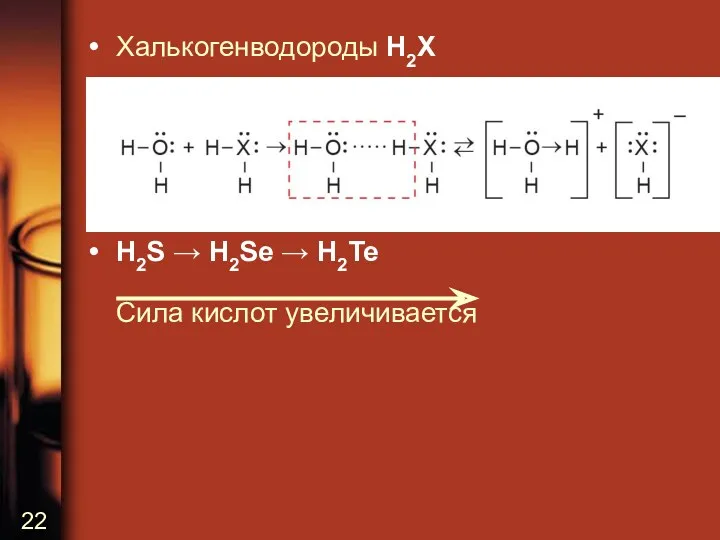
• Халькогенводороды H2X
• H2S → H2Se → H2Te
Сила кислот увеличивается
Слайд 23

• Галогенводороды HГ
• HCl → HBr → HI
Сила кислот увеличивается
H–F H–F
H–F [H–F→H]+ + [H–F→H]–
(H2F+ + HF2–)
• HF – слабая кислота!
Слайд 24

Бинарные соединения
Галогениды как характеристические соединения
Слайд 25
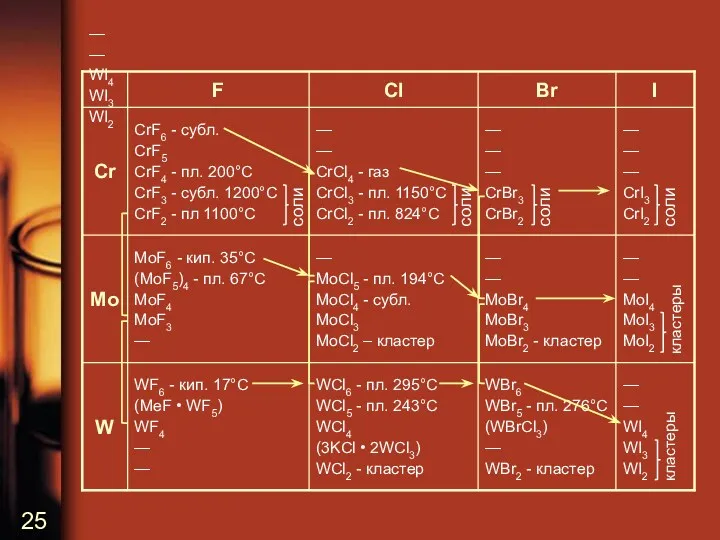
—
—
WI4
WI3
WI2
соли
соли
кластеры
кластеры
соли
соли
Слайд 26
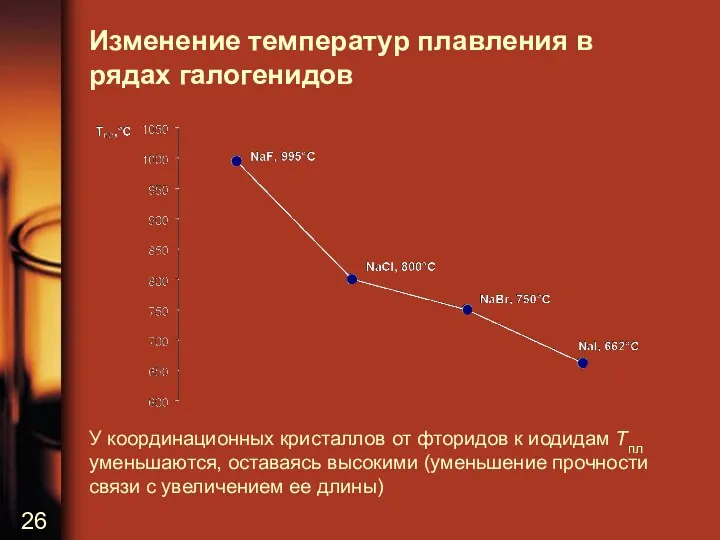
Изменение температур плавления в рядах галогенидов
У координационных кристаллов от фторидов к
иодидам Tпл уменьшаются, оставаясь высокими (уменьшение прочности связи с увеличением ее длины)
Слайд 27

Изменение температур плавления в рядах галогенидов
У молекулярных структур от фторидов к
иодидам Tпл увеличиваются, оставаясь низкими (усиление дисперсионного Ван-дер-Ваальсова взаимодействия с увеличением поляризации связи)
Слайд 28

Эволюция степеней окисления катионообразователя при нагревании
PtCl4 → PtCl3 → PtCl2 →
PtCl → Pt
Ptl4 → Ptl3 → Ptl2 → Pt
370°C
435°C
581°C
583°C
263°C
272°C
355°C
Слайд 29

Полный гидролиз «по катиону»
• BBr3 + 3H2O → 3HBr + H3BO3
• SiCl4 +
2H2O → 4HCl + SiO2
• CCl4, SF6, NI3 в воде нерастворимы
(нет гидролиза)
Слайд 30

Изменение восстановительных свойств в ряду галогенид-ионов
NaF(к) + H2SO4(конц) → NaHSO4 +
HF↑
NaCl(к) + H2SO4(конц) → NaHSO4 + HCl↑
2NaBr(к) + 2H2SO4(конц) → Na2SO4 + Br +
SO2↑ + 2H2O
Br– восстанавливает H2SO4 до SO2
8NaI(к) + 5H2SO4(конц) → 4Na2SO4 + 4I +
H2S↑ + 4H2O
I– восстанавливает H2SO4 до H2S
Слайд 31
![Галогенидные ацидокомплексы Типичное к.ч. 4: K2[HgI4], H[AuCl4] Для фторидов помимо](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/409001/slide-30.jpg)
Галогенидные ацидокомплексы
Типичное к.ч. 4: K2[HgI4], H[AuCl4]
Для фторидов помимо к.ч. 4 есть
к.ч. 6: MeI2[BeF4], MeI3[AlF6], MeI2[SiF6],
Слайд 32

Бинарные соединения
Кислородсодержащие соединения
Слайд 33

Классификация
Соединения не подчиняющиеся правилу формальной валентности
анионоизбыточные соединения
пероксиды (Na2O2, CaO2, …)
ст.окисления кислорода
–1)
супероксиды (надпероксиды) (KO2, …)
ст.окисления –1/2)
озониды (KO3, …) ст.окисления –1/3
катионоизбыточные соединения – металлидные фазы типа соединений Курнакова (Ti6O, Ti3O, …)
Слайд 34

Классификация
Характеристические соединения – подчиняющиеся правилу формальной валентности, оксиды с ионно-ковалентным типом
связи
солеообразующие
основные (оксиды металлов в невысоких степенях окисления)
кислотные (оксиды неметаллов в любых степенях окисления и металлов в высоких степенях окисления)
амфотерные (оксиды металлов в промежуточных степенях окисления +2…+4 при ОЭО 1,4…1,8)
несолеообразующие (CO, N2O, NO) – им не соответствуют гидроксиды и от них не происходят соли
Слайд 35

Характерные структурные типы оксидов в зависимости
от природы химической связи
Слайд 36

Оксиды ЭО
Структурный тип NaCl
MgO, PbO, TiO,…
к.ч. = 6; 6
Вюрцит
ZnO, BeO…
к.ч. =
4; 4
Слайд 37
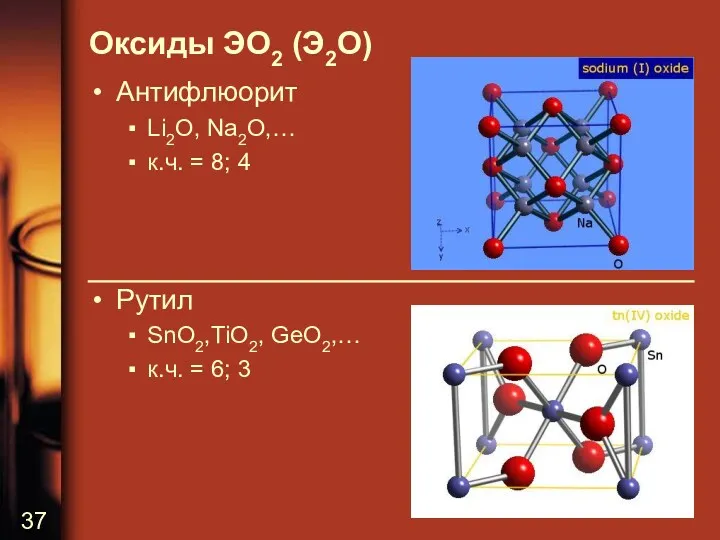
Оксиды ЭО2 (Э2О)
Антифлюорит
Li2O, Na2O,…
к.ч. = 8; 4
Рутил
SnO2,TiO2, GeO2,…
к.ч. = 6; 3
Слайд 38

Оксиды ЭО2
Структурный тип SiO2
к.ч. = 4; 2
Молекулярные
структуры
CO2,…
Малополярные
ковалентные связи
Слайд 39
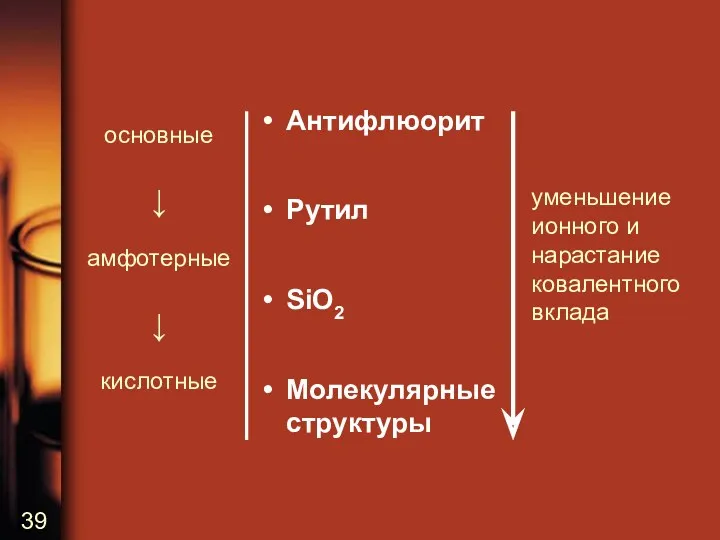
Антифлюорит
Рутил
SiO2
Молекулярные
структуры
уменьшение ионного и нарастание ковалентного вклада
основные
↓
амфотерные
↓
кислотные
Слайд 40

Структуры характеристических оксидов элементов IVA-VIIA-групп
Слайд 41
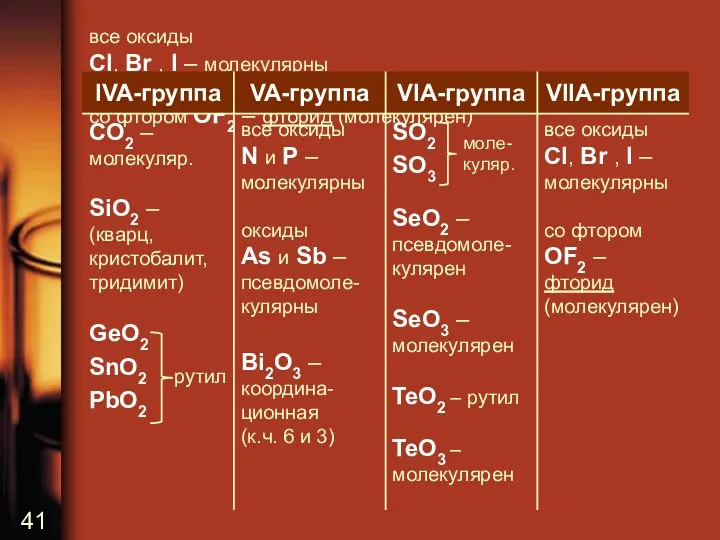
все оксиды
Cl, Br , I – молекулярны
со фтором OF2 – фторид
(молекулярен)
рутил
моле-куляр.
Слайд 42
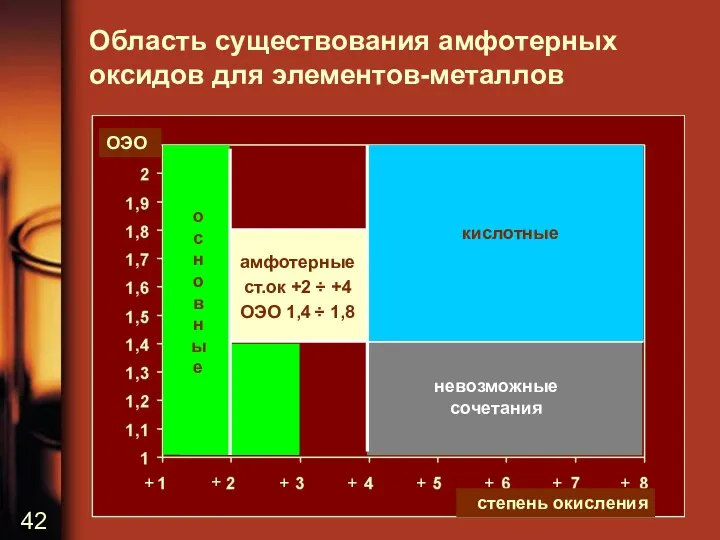
Область существования амфотерных оксидов для элементов-металлов
невозможные сочетания
амфотерные
ст.ок +2 ÷ +4
ОЭО 1,4
÷ 1,8
кислотные
о
с
н
о
в
н
ы
е
+
+
+
+
+
+
+
+
ОЭО
степень окисления













![Хлор, фтор, бром, йод Cl — макроэлемент [0,15%], остальные —](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/409001/slide-14.jpg)

![Бром В организме всего 7 мг [10–5%]. Локализуется в железах](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/409001/slide-16.jpg)
![Бром В организме всего 7 мг [10–5%]. Локализуется в железах](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/409001/slide-17.jpg)












![Галогенидные ацидокомплексы Типичное к.ч. 4: K2[HgI4], H[AuCl4] Для фторидов помимо](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/409001/slide-30.jpg)











 Теория сильных и слабых электролитов
Теория сильных и слабых электролитов Соединения серы
Соединения серы Установление точной концентрации раствора щелочи по титрованному раствору соляной кислоты. (Лабораторная работа 1)
Установление точной концентрации раствора щелочи по титрованному раствору соляной кислоты. (Лабораторная работа 1) Практична робота 3 Самедова Софія (1)
Практична робота 3 Самедова Софія (1) Летучие яды
Летучие яды Природный каучук
Природный каучук Простые вещества - неметаллы. 8 класс
Простые вещества - неметаллы. 8 класс Полімери. Природні полімери
Полімери. Природні полімери Инструментальные методы исследования органических веществ
Инструментальные методы исследования органических веществ Полиамидные волокна
Полиамидные волокна Синтетические органические вещества
Синтетические органические вещества Теория электролитической диссоциации
Теория электролитической диссоциации Приборы и методы исследования в химической технологии
Приборы и методы исследования в химической технологии Степень диссоциации. 9 класс
Степень диссоциации. 9 класс Классы неорганических соединений
Классы неорганических соединений Углеводородное топливо, его виды и назначения
Углеводородное топливо, его виды и назначения Предмет органической химии
Предмет органической химии Актуальные вопросы содержания контрольных измерительных материалов ЕГЭ в 2019 г
Актуальные вопросы содержания контрольных измерительных материалов ЕГЭ в 2019 г Алкены. Химические свойства алкенов
Алкены. Химические свойства алкенов Хімічні властивості кислот
Хімічні властивості кислот Состав, свойства, виды и способы получения дегтей
Состав, свойства, виды и способы получения дегтей Анализ и синтез химических веществ
Анализ и синтез химических веществ Химическая технология ситаллов и композитов. Прессование
Химическая технология ситаллов и композитов. Прессование Общая характеристика физико-химических методов анализа лекарственных веществ
Общая характеристика физико-химических методов анализа лекарственных веществ Коллигативные свойства растворов неэлектролитов
Коллигативные свойства растворов неэлектролитов Алкены. Пропилен C₃H₆
Алкены. Пропилен C₃H₆ Металлы и их свойства. Способы получения
Металлы и их свойства. Способы получения Химическая термодинамика
Химическая термодинамика