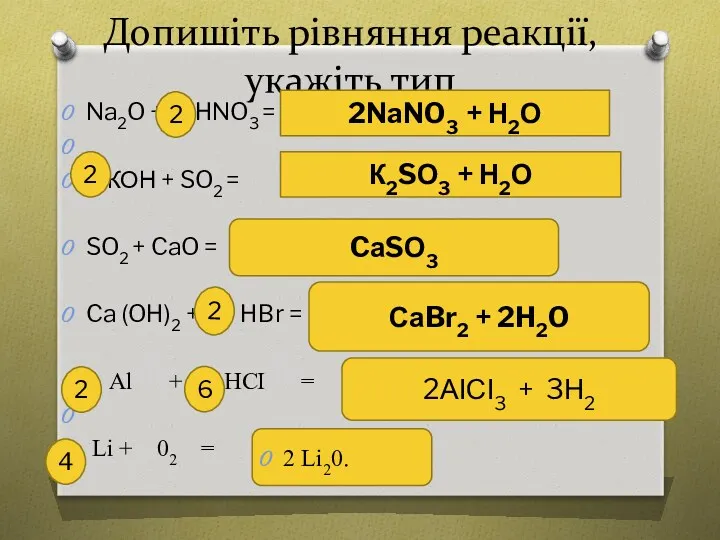
Задача Обчисліть масу солі, що утвориться при взаємодії 4 г купрум
(ІІ) оксиду з надлишком розчину хлоридної кислоти.
1. Знаходжу кількість речовини купрум (ІІ) оксиду
М(СuО)= 64+ 16= 80 г/моль
n(СuО) = m/ М= 4г/ 80г/моль =0,05 моль.
Відповідь: m(СuСІ2) = 6,75 г
Дано:
m(СuО) = 4 г
+ HСІ
m(солі) -?
2. Записую рівняння реакції:
0,05 моль х моль
СuО+ 2HСІ= СuСІ2 + Н2О
1 моль 1 моль
Х= 0,05 моль
3. Знаходжу масу солі
m(СuСІ2) = n*М (СuСІ2 )
*М (СuСІ2 )= 64 + 35,5*2=135 г/ моль
m(СuСІ2) = n*М (СuСІ2 )= 135 г/моль* 0,05 моль = 6,75 г.










 Химические свойства алкенов
Химические свойства алкенов Хімічний склад і використання мінералів
Хімічний склад і використання мінералів Получение уксусной кислоты и опыты с ней
Получение уксусной кислоты и опыты с ней Термокаталитические процессы. Каталитический крекинг. Классификация и основные факторы процесса
Термокаталитические процессы. Каталитический крекинг. Классификация и основные факторы процесса Классификация органических соединений
Классификация органических соединений Классы неорганических соединений. 8 класс
Классы неорганических соединений. 8 класс Знаки вторичной переработки
Знаки вторичной переработки Застосуванння електролiзу
Застосуванння електролiзу Магматические формации
Магматические формации Человек в мире веществ, материалов и химических реакций. Химия и пища
Человек в мире веществ, материалов и химических реакций. Химия и пища Химическая связь в кластерах
Химическая связь в кластерах Окислительно-восстановительные реакции в органической химии
Окислительно-восстановительные реакции в органической химии Общая характеристика элементов V группы главной подгруппы
Общая характеристика элементов V группы главной подгруппы Ароматические углеводороды. Арены
Ароматические углеводороды. Арены Катализ. Классификация каталитических процессов. Механизм действия катализаторов
Катализ. Классификация каталитических процессов. Механизм действия катализаторов Структура стекла
Структура стекла Свойства кислот и оснований в свете теории электролитической диссоциации
Свойства кислот и оснований в свете теории электролитической диссоциации Фосфор и его основные соединения
Фосфор и его основные соединения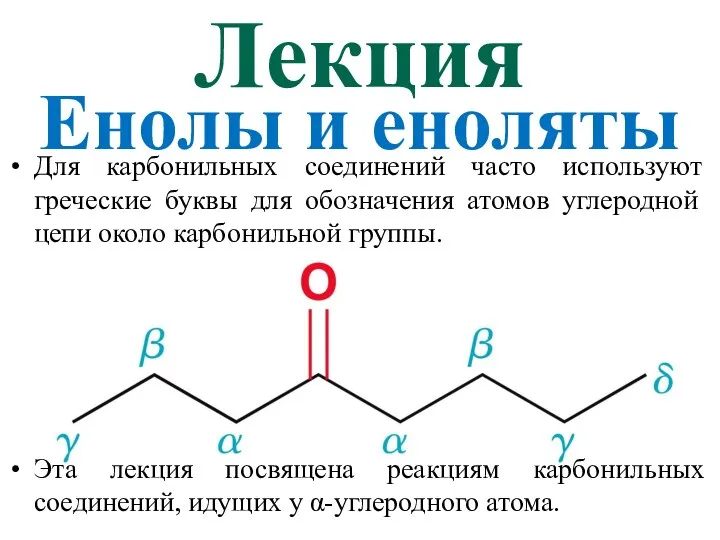 Енолы и еноляты
Енолы и еноляты Ступінь окиснення. Визначення ступеня окиснення елемента за хімічною формулою сполуки
Ступінь окиснення. Визначення ступеня окиснення елемента за хімічною формулою сполуки Химические процессы в атмосфере. Загрязнение атмосферы. Причины и последствия
Химические процессы в атмосфере. Загрязнение атмосферы. Причины и последствия Белки. 9 класс
Белки. 9 класс Коррозия и защита строительных материалов
Коррозия и защита строительных материалов ЕГЭ Химия. Задание №5
ЕГЭ Химия. Задание №5 Сопряжение. Ароматичность. Электронные эффекты заместителей
Сопряжение. Ароматичность. Электронные эффекты заместителей Химическая связь. Взаимное влияние атомов в молекуле
Химическая связь. Взаимное влияние атомов в молекуле Ізомери у природі
Ізомери у природі Полимеры. Пластмассы. Волокна
Полимеры. Пластмассы. Волокна