Содержание
- 2. Цель урока: Обобщить и систематизировать знания об основных классах неорганических веществ. Задачи: • Закрепить и обобщить
- 3. Ум заключается не только в знании, но и в умении прилагать знание на деле. Аристотель
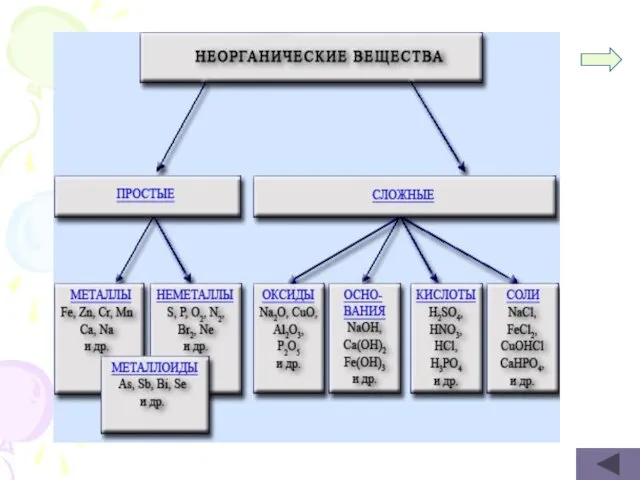
- 5. Классы неорганических веществ
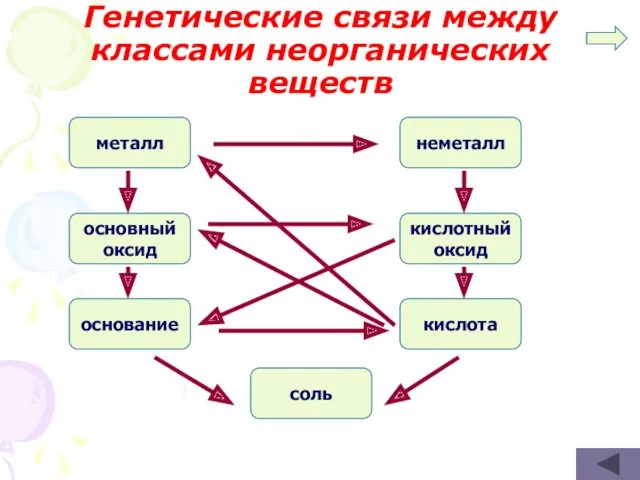
- 6. Генетические связи между классами неорганических веществ металл основный оксид основание неметалл кислотный оксид кислота соль
- 7. Оксиды Состав Классификация Физические свойства Химические свойства Получение Применение
- 8. Основания Состав Классификация Физические свойства Химические свойства Получение Применение
- 9. Кислоты Состав Классификация Физические свойства Химические свойства Получение Применение
- 10. Соли Состав Классификация Физические свойства Химические свойства Получение Применение
- 11. Классификация оксидов оксиды несолеобразующие солеобразующие кислотные основные амфотерные Na2O, CaO ZnO, Al2O3, BeO SO2, SO3, P2O5
- 12. Классификация оснований Основания (по растворимости) растворимые нерастворимые (щелочи) основания KOH, NaOH Fe(OH)2, Pb(OH)2 Основания (по кислотности)
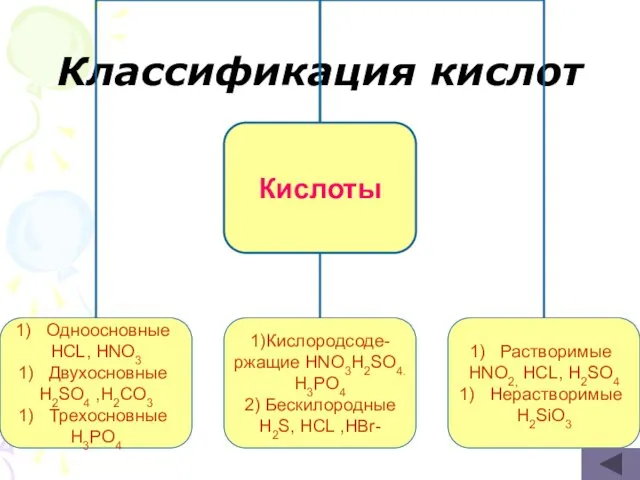
- 13. Классификация кислот
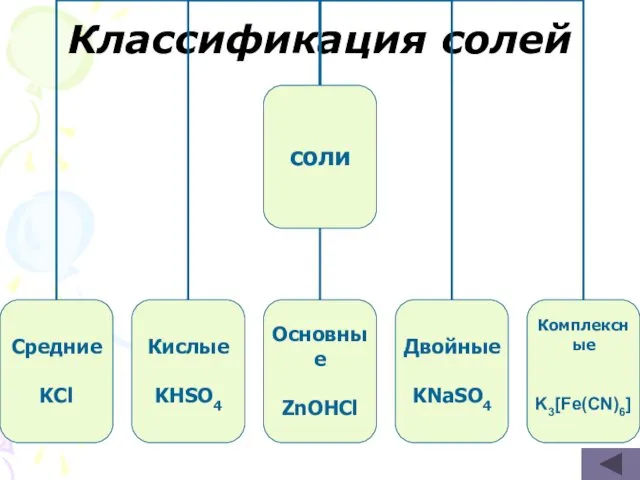
- 14. Классификация солей
- 15. Сложные вещества, состоящие из двух химических элементов, один из которых – кислород в степени окисления -2.
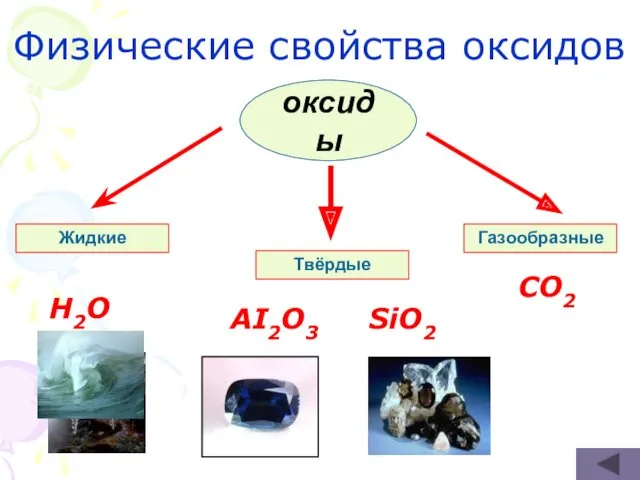
- 16. Физические свойства оксидов оксиды Жидкие Твёрдые Газообразные H2O AI2O3 SiO2 CO2
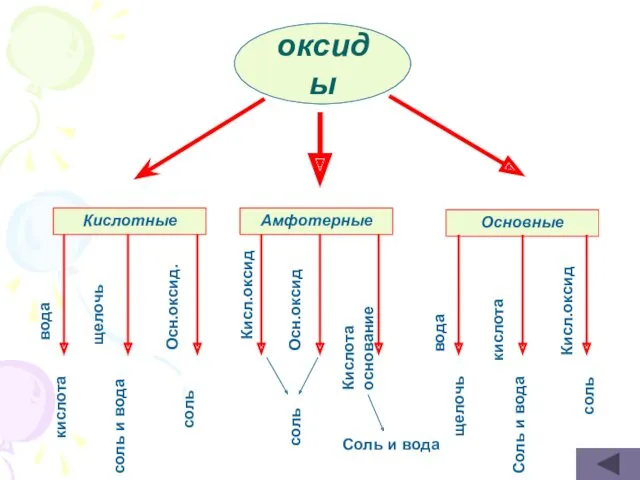
- 17. оксиды Кислотные Амфотерные Основные вода щелочь Осн.оксид. кислота соль и вода соль Кисл.оксид Осн.оксид Кислота основание
- 18. Получение оксидов Окисление кислородом простых веществ 2MgO +O2=2MgO Окисление кислородом cложных веществ 2H2S+3O2=2H2O+2SO2 Разложение нагреванием солей
- 19. Применение оксидов Оксид цинка ZnO – вещество белого цвета, используется для приготовления белой масляной краски (цинковые
- 20. Оксид кремния (IV) SiO2 Кварц, кремень, горный хрусталь, аметист, яшма, опал — все это оксид кремния
- 21. Основания Сложные вещества, состоящие из атомов металлов и соединённых с ним одной или нескольких гидроксидных групп.
- 22. Физические свойства оснований Твердые кристаллические вещества. В воде растворимы щелочи:LiOH, NaOH, KOH, CsOH, RbOH, Ca(OH)2, Sr(OH)2,Ba(OH)2
- 23. Щелочи - едкие вещества. Они разъедают кожу и ткани. Поэтому технические названия некоторых из них указывают
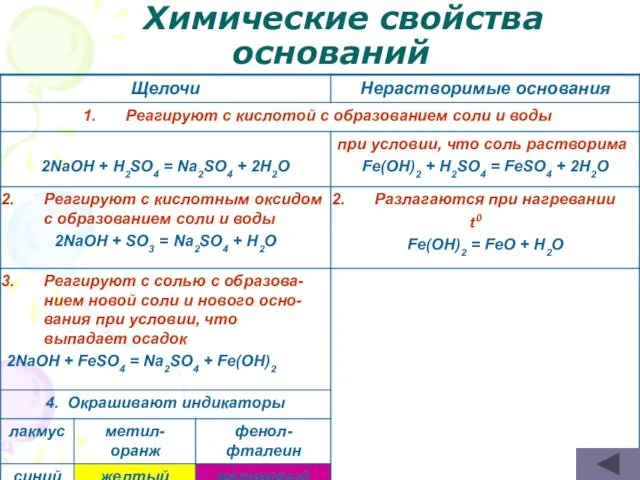
- 24. Химические свойства оснований
- 25. Получение оснований Щелочи получают: а) взаимодействием активных металлов с водой 2Na + 2H2O = 2NaOH +
- 26. Применение оснований Гидроксид натрия NaOH (едкий натр, каустическая сода),применяется в производстве бумаги, мыла, волокон, очистке нефтепродуктов
- 27. Кислоты Кислотами называются сложные вещества, состоящие из атомов водорода, способных замещаться на металл, и кислотного остатка.
- 28. Физические свойства Большинство кислот не имеют цвета и запаха , кислые на вкус, хорошо растворяются в
- 29. Химические свойства кислот Кислота + основание = соль + вода H2SO4 +2 NaOH = Na2SO4 +
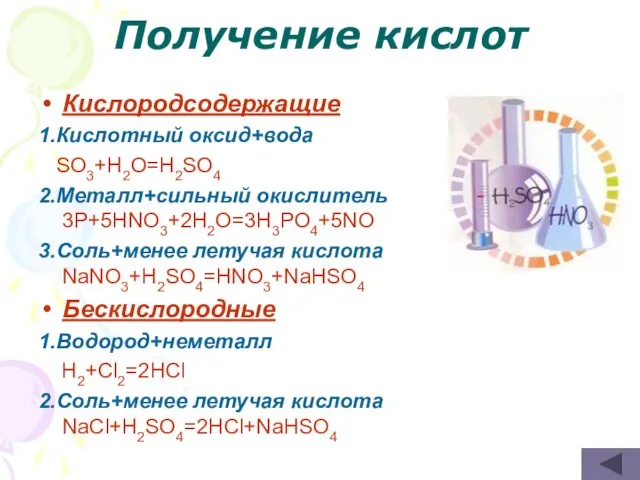
- 30. Получение кислот Кислородсодержащие 1.Кислотный оксид+вода SO3+H2O=H2SO4 2.Металл+сильный окислитель 3P+5HNO3+2H2O=3H3PO4+5NO 3.Cоль+менее летучая кислота NaNO3+H2SO4=HNO3+NaHSO4 Бескислородные 1.Водород+неметалл H2+Cl2=2HCl
- 31. Применение кислот 1- производство кислот, 2-взрывчатых веществ, 3-минеральных удобрений, 4- электролитической меди, 5-эмали, 6-солей, 7- искусственного
- 32. Соли Солями называются сложные вещества, представляющие собой продукты полного или частичного замещения водорода в кислоте на
- 33. ФИЗИЧЕСКИЕ СВОЙСТВА СОЛЕЙ Соли-твердые кристаллические вещества. Многие из них имеют высокие температуры плавления и кипения. По
- 34. ХИМИЧЕСКИЕ СВОЙСТВА CОЛЕЙ Разложение при прокаливании CaCO3 = CaO + CO2 Cоль+металл Cu + Hg(NO3)2 =
- 35. Получение солей металл+неметалл 2Mg+Cl2=MgCl2 металл+кислота Zn+2HCl=ZnCI2+H2 металл+соль Hg(NO3)2+Cu=Hg+Cu(NO3)2 основной оксид+кислота CaO+2HCl=CaCl2+H2O кислотный оксид+основание CO2+Ca(OH)2=CaCO3+H2O кислотный+основной оксиды
- 36. Применение солей 1-5- производство химических веществ (соляной кислоты, гидроксида натрия, хлора, натрия, соды), 6- для консервирования,
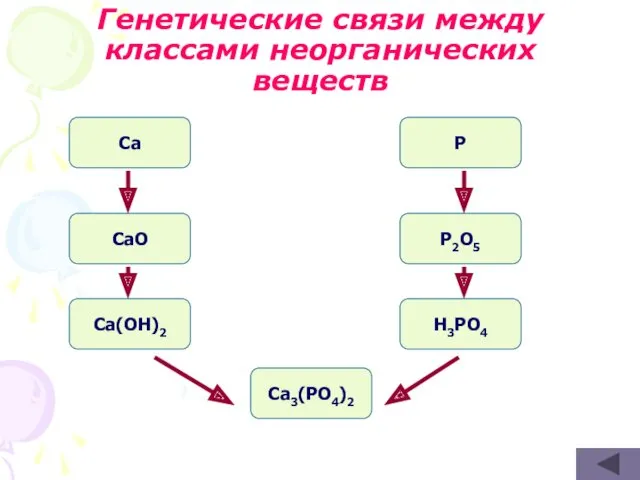
- 37. Генетические связи между классами неорганических веществ Ca CaO Ca(OH)2 P P2O5 H3PO4 Ca3(PO4)2
- 38. Дальтон Джон (1766–1844) Йёнс Якоб Берцелиус (1779–1848) Предложил систему химических знаков для «простых» и «сложных» атомов.
- 39. Лавуазье Антуан Лоран (1743–1794) Ломоносов Михаил Васильевич (1711–1765) Разработал новую химическую номенклатуру и классификацию тел, разделив
- 40. Домашнее задание 1 уровень. Осуществите превращения: Ba → BaO → Ba(OH)2 →BaCI2 → BaSO4 2 уровень.
- 41. Рефлексия Красный – я узнал много интересной и полезной информации Жёлтый – было интересно, но трудно.
- 42. Спасибо за урок!
- 44. Скачать презентацию
































 Основи. Склад, назви, класифікація, використання
Основи. Склад, назви, класифікація, використання Насичені одноатомні спирти, їх фізичні та хімічні властивості. Одержання етанолу
Насичені одноатомні спирти, їх фізичні та хімічні властивості. Одержання етанолу Тепловой эффект химической реакции
Тепловой эффект химической реакции Переходные элементы
Переходные элементы Природный и попутный нефтяной газы
Природный и попутный нефтяной газы Химическая связь
Химическая связь Тепловой эффект химической реакции, термохимические уравнения, экзо- и эндотермические реакции
Тепловой эффект химической реакции, термохимические уравнения, экзо- и эндотермические реакции Хімічні властивості кислот
Хімічні властивості кислот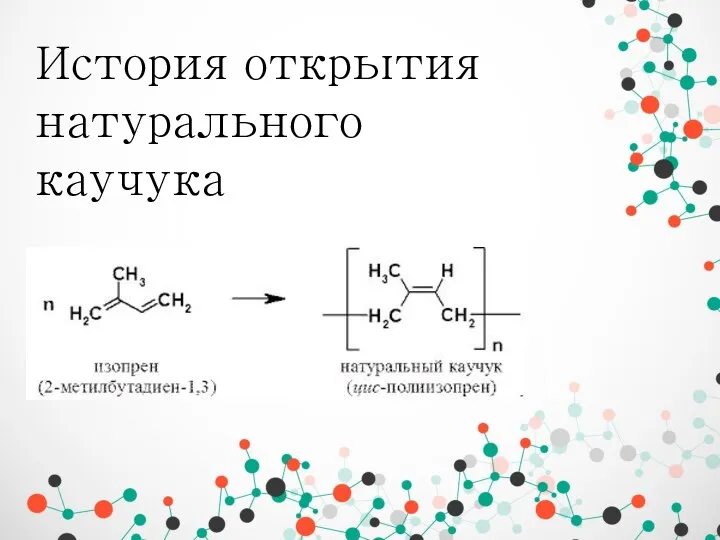 История открытия натурального каучука
История открытия натурального каучука Минералогический состав почв
Минералогический состав почв Простые вещества. Металлы и неметаллы
Простые вещества. Металлы и неметаллы Жорсткість води і методи її усунення. 11 клас
Жорсткість води і методи її усунення. 11 клас Химический элемент радий
Химический элемент радий Ask the right question to find the best answer
Ask the right question to find the best answer Количественная характеристика растворов, растворение, растворимость
Количественная характеристика растворов, растворение, растворимость Водород
Водород Силикатная промышленность. 9 класс
Силикатная промышленность. 9 класс Природные (натуральные) полимеры. Композиционные материалы
Природные (натуральные) полимеры. Композиционные материалы Серная кислота
Серная кислота Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Цинк(ZN), хром(Cr). Зовнішній вигляд простої речовини
Цинк(ZN), хром(Cr). Зовнішній вигляд простої речовини Кислород. Электронное строение и свойства
Кислород. Электронное строение и свойства Реакции солей в растворе. Гидролиз солей. Водородный показатель рН
Реакции солей в растворе. Гидролиз солей. Водородный показатель рН Щелочи
Щелочи Общая геохимия. Периодический закон Менделеева. Строение электронных оболочек. Геохимические классификации элементов
Общая геохимия. Периодический закон Менделеева. Строение электронных оболочек. Геохимические классификации элементов Кремний и его соединения для 11 класса
Кремний и его соединения для 11 класса Перманганат калия
Перманганат калия Химическая промышленность Донецкой области
Химическая промышленность Донецкой области