Содержание
- 2. Кремний в ПС. Аллотропные модификации. Кристаллический кремний (алмазоподобная структура). Тёмно-серое со стальным блеском твёрдое хрупкое вещество.
- 3. Кремний в природе Агат Аметист Кварц Кремень SiO2
- 4. Разновидности минералов на основе оксида кремния Агат Горный хрусталь Кварц Цитрин Кошачий глаз Аметист Яшма Сердолик
- 5. Среди соединений кремния распространены алюмосиликаты (соединения, содержащие оксид алюминия). Среди алюмосиликатов наибольшее распространение имеют белая глина
- 6. Получение кремния Кремний получают восстановлением оксида кремния (IV) углеродом или магнием при нагревании: SiO2 + 2Mg
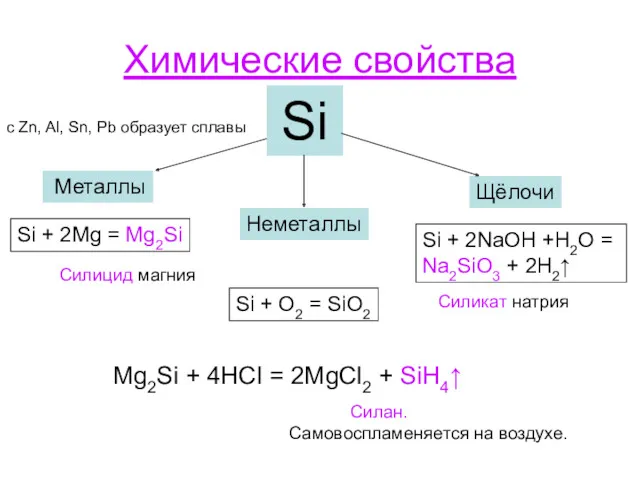
- 7. Химические свойства Si Металлы Неметаллы Щёлочи Si + 2Mg = Mg2Si Силицид магния Si + O2
- 8. Si + 2Cl2 SiCl4 Si + 2S SiS2 Si + C SiC Si + P =
- 9. Вода Si + 2H2O (пар) = SiO2 + 2H2 Основные оксиды : 2MgO + 3Si =
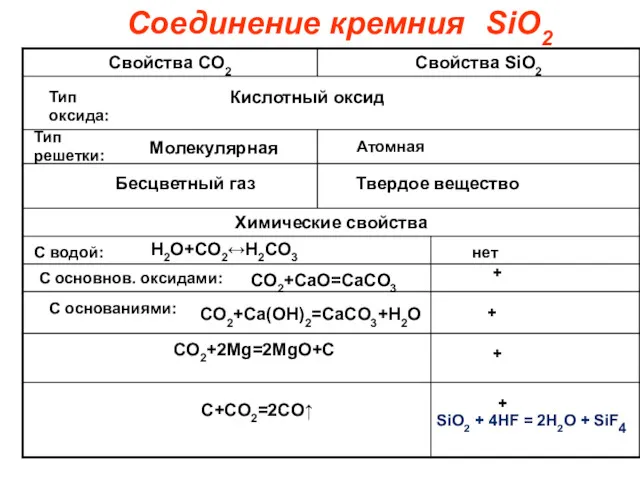
- 10. Соединение кремния Кислотный оксид Молекулярная Атомная Тип оксида: Тип решетки: Бесцветный газ Твердое вещество С водой:
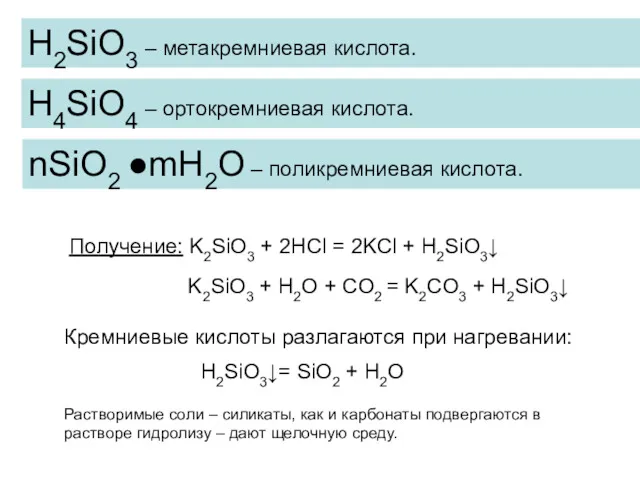
- 11. Кислородные соединения кремния SiO2 – оксид кремния (IV), кремнезём. Кислотный оксид. Твёрдое тугоплавкое вещество с атомной
- 12. H4SiO4 – ортокремниевая кислота. Получение: K2SiO3 + 2HCl = 2KCl + H2SiO3↓ H2SiO3 – метакремниевая кислота.
- 13. Получение кремниевой кислоты Силикатный клей Кремниевая кислота Силикагель
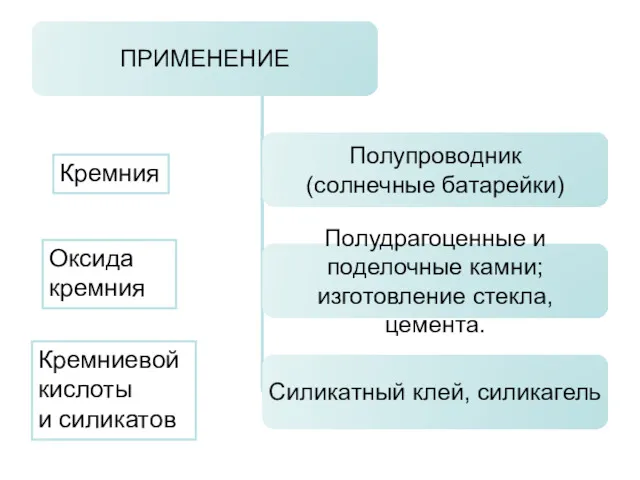
- 14. Кремния Оксида кремния Кремниевой кислоты и силикатов
- 15. это отрасль промышленности, занимающаяся переработкой природных соединений кремния. К ней относится производство фарфора, керамики, фаянса, стекла,
- 19. Тест
- 20. 1.
- 21. 2.
- 22. 3.
- 23. 4.
- 24. 5.
- 25. 6.
- 26. 7.
- 27. 8.
- 28. 9.
- 29. 10.
- 30. 11.
- 31. 12.
- 32. 13.
- 34. Скачать презентацию



























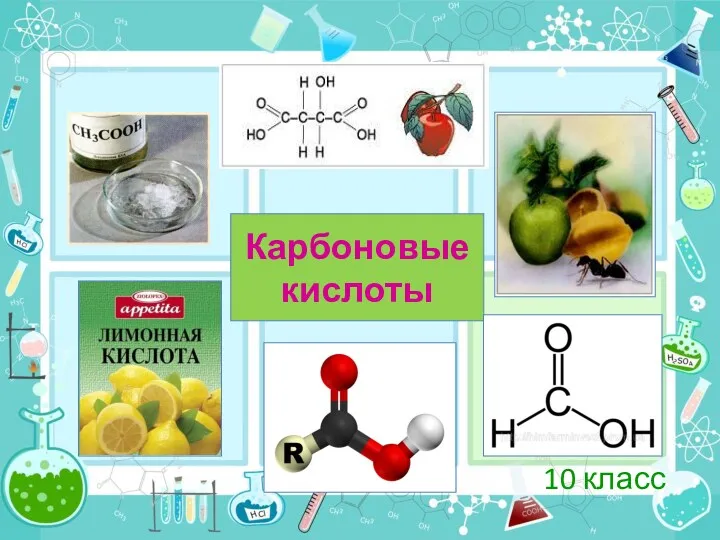 Карбоновые кислоты. 10 класс
Карбоновые кислоты. 10 класс Взаимодействие кислоты с основанием (реакция нейтрализации)
Взаимодействие кислоты с основанием (реакция нейтрализации)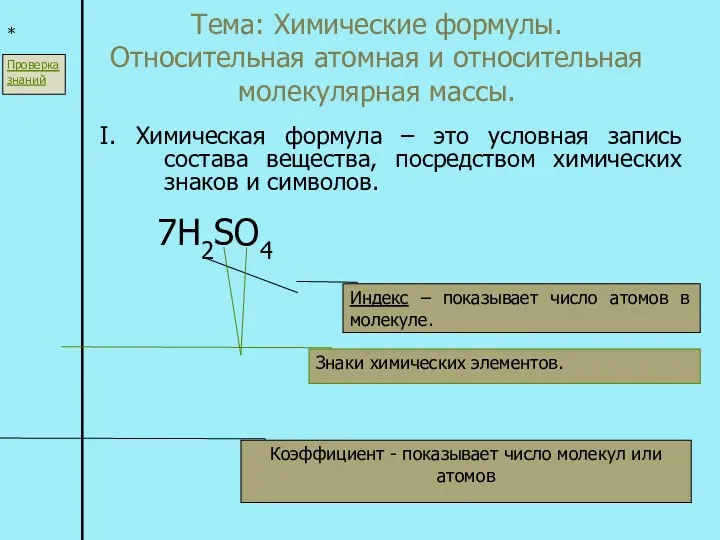 Химические формулы. Относительная атомная и относительная молекулярная массы
Химические формулы. Относительная атомная и относительная молекулярная массы Автомобильные пластичные смазки
Автомобильные пластичные смазки Кристаллы. Кристаллические вещества
Кристаллы. Кристаллические вещества Периодическая система химических элементов Д.И. Менделеева. Строение атома
Периодическая система химических элементов Д.И. Менделеева. Строение атома Витаминдер. Витаминдердің классификациясы. Алиментарлы және екіншілік авитаминоздар. Гипервитаминоздар
Витаминдер. Витаминдердің классификациясы. Алиментарлы және екіншілік авитаминоздар. Гипервитаминоздар Приготовление растворов с определенной массовой долей растворенного вещества. Практическая работа
Приготовление растворов с определенной массовой долей растворенного вещества. Практическая работа Полимеры органические и неорганические
Полимеры органические и неорганические Лабораторна робота. Властивості амінів
Лабораторна робота. Властивості амінів Электролиз
Электролиз Роль химии в современной цивилизации
Роль химии в современной цивилизации Углеводородное сырье: способы переработки
Углеводородное сырье: способы переработки Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы
Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы Осмий. Нахождение в природе
Осмий. Нахождение в природе Альдегиды и кетоны
Альдегиды и кетоны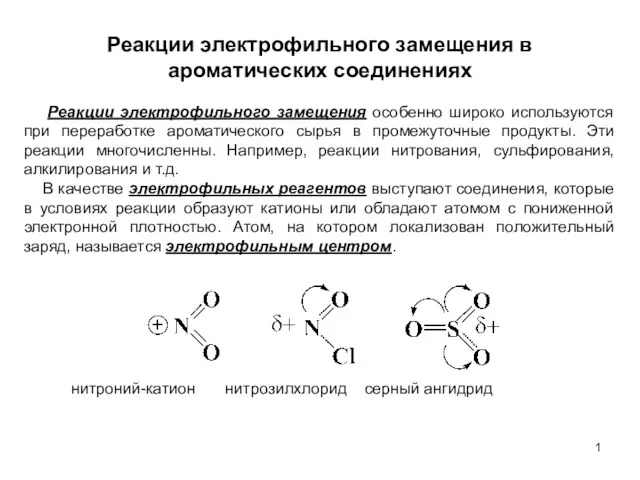 Реакции электрофильного замещения в ароматических соединениях. (Лекция 6)
Реакции электрофильного замещения в ароматических соединениях. (Лекция 6) Триглицериды. Липиды. Средства ухода за кожей. Лекция 3. Индустрия красоты
Триглицериды. Липиды. Средства ухода за кожей. Лекция 3. Индустрия красоты Ауыл шаруашылығындағы минералды. Тыңайтқыш-азық-түліктегі нитраттар
Ауыл шаруашылығындағы минералды. Тыңайтқыш-азық-түліктегі нитраттар Тепловий ефект хімічних реакцій. Екзотермічні ї ендотермічні реакції термохімічні рівняння
Тепловий ефект хімічних реакцій. Екзотермічні ї ендотермічні реакції термохімічні рівняння Осадочные и метаморфические горные породы
Осадочные и метаморфические горные породы Объемная доля компонента газовой смеси
Объемная доля компонента газовой смеси Органічна хімія
Органічна хімія Первичная переработка нефти
Первичная переработка нефти Nuclear Energy, Controlled Fission and Fusion 2016
Nuclear Energy, Controlled Fission and Fusion 2016 Гидроксикислоты (оксикислоты)
Гидроксикислоты (оксикислоты) Лекция 3. Протолитические равновесия и процессы
Лекция 3. Протолитические равновесия и процессы Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования
Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования