Содержание
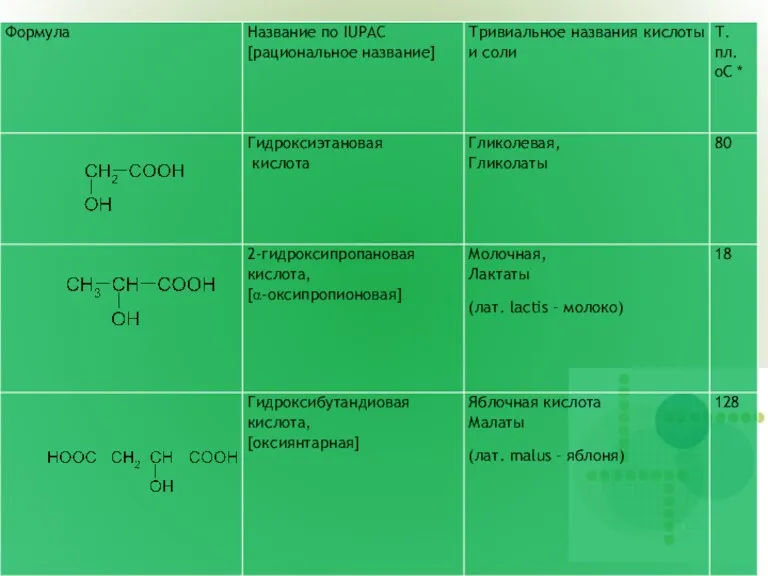
- 2. ГИДРОКСИКИСЛОТЫ (ОКСИКИСЛОТЫ) Гидроксикислоты содержат в молекуле две функциональные группы – карбоксильную (COOH) и гидроксильную (OH) Номенклатура
- 4. 13.11.12
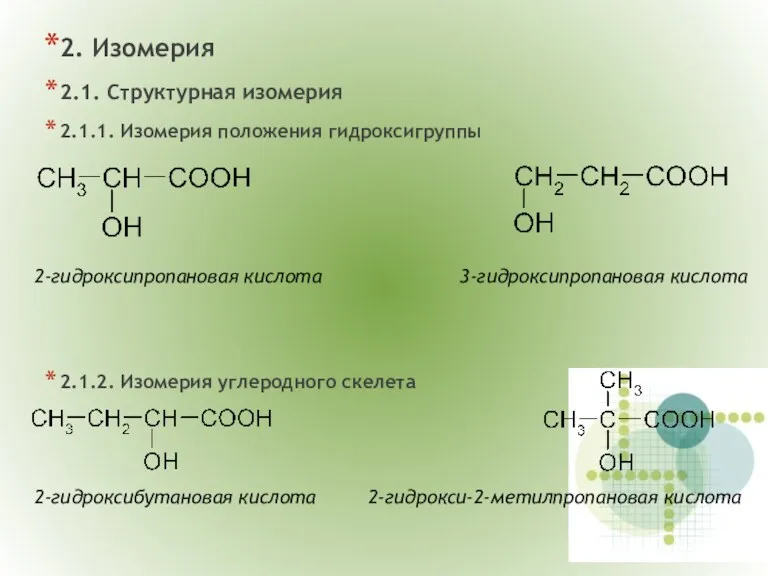
- 5. 2. Изомерия 2.1. Структурная изомерия 2.1.1. Изомерия положения гидроксигруппы 2.1.2. Изомерия углеродного скелета 2-гидроксипропановая кислота 3-гидроксипропановая
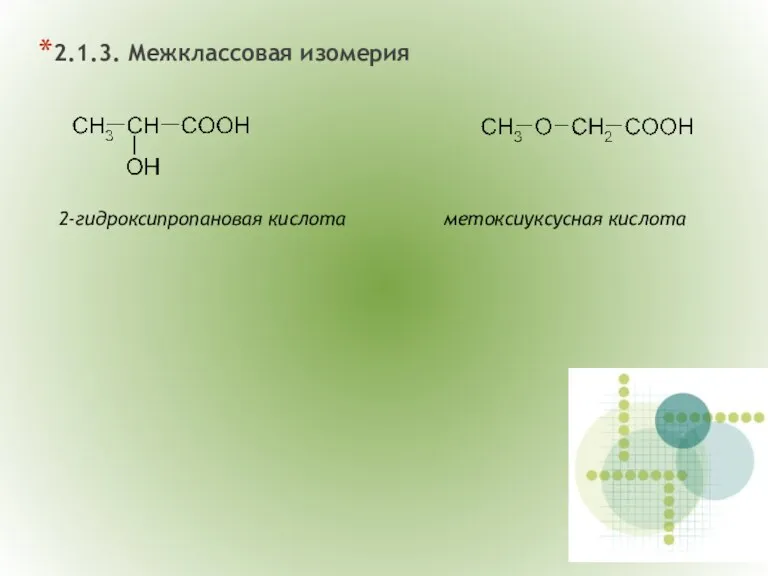
- 6. 2.1.3. Межклассовая изомерия 2-гидроксипропановая кислота метоксиуксусная кислота
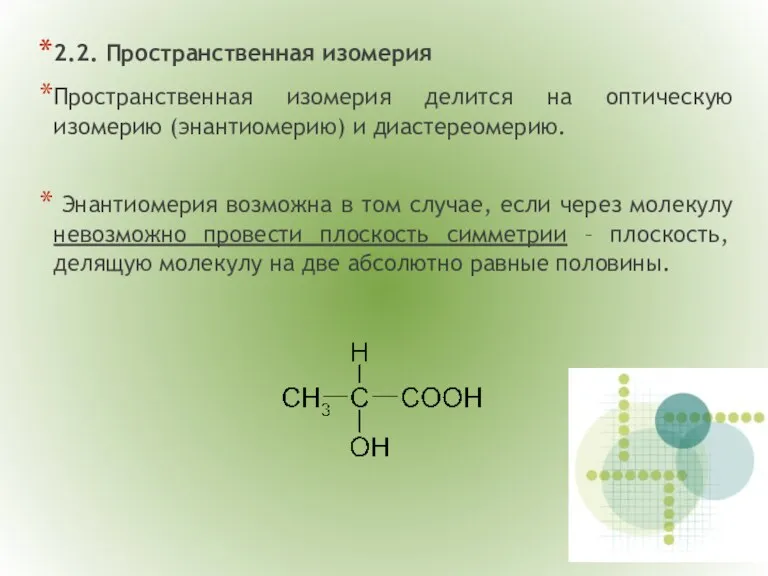
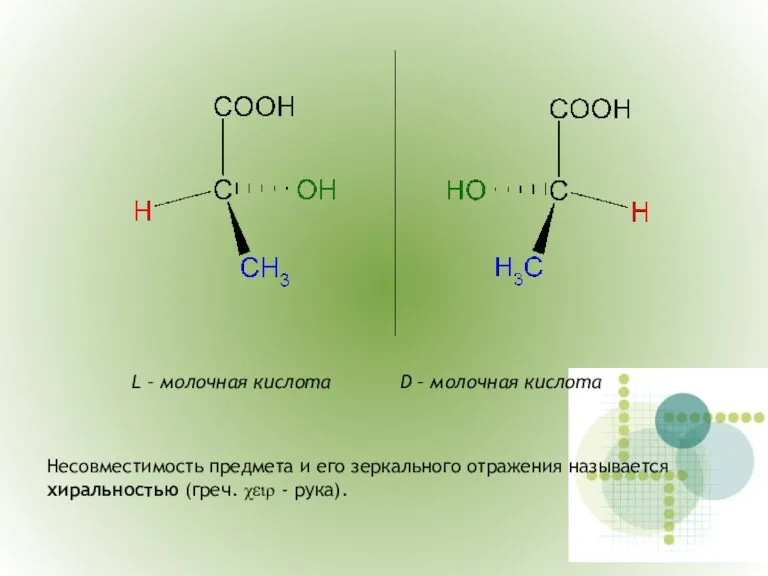
- 7. 2.2. Пространственная изомерия Пространственная изомерия делится на оптическую изомерию (энантиомерию) и диастереомерию. Энантиомерия возможна в том
- 8. L – молочная кислота D – молочная кислота Несовместимость предмета и его зеркального отражения называется хиральностью
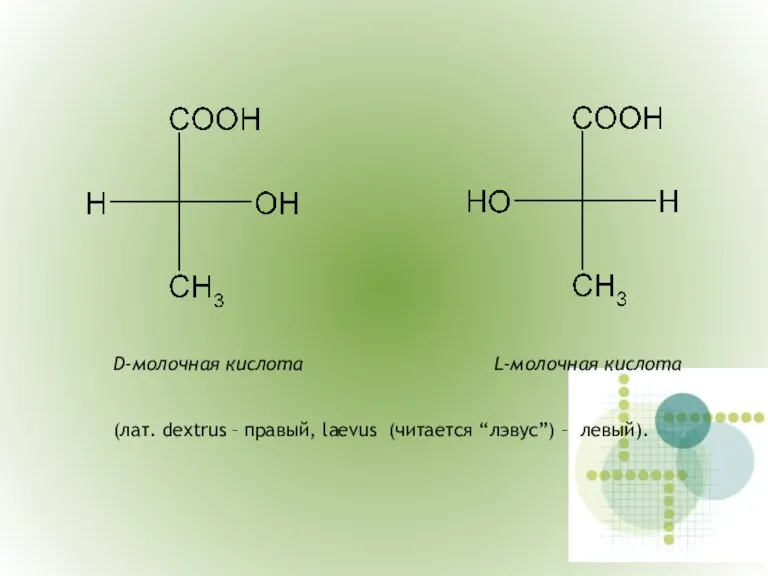
- 9. D-молочная кислота L-молочная кислота (лат. dextrus – правый, laevus (читается “лэвус”) – левый).
- 10. 2. Физические и биологические свойства Гидроксикислоты являются, как правило, твёрдыми телами. Рацемическая молочная кислота может быть
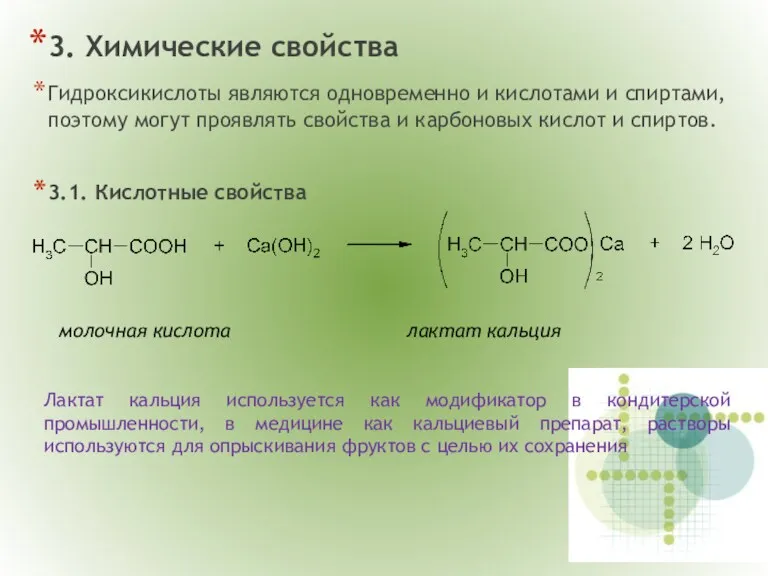
- 11. 3. Химические свойства Гидроксикислоты являются одновременно и кислотами и спиртами, поэтому могут проявлять свойства и карбоновых
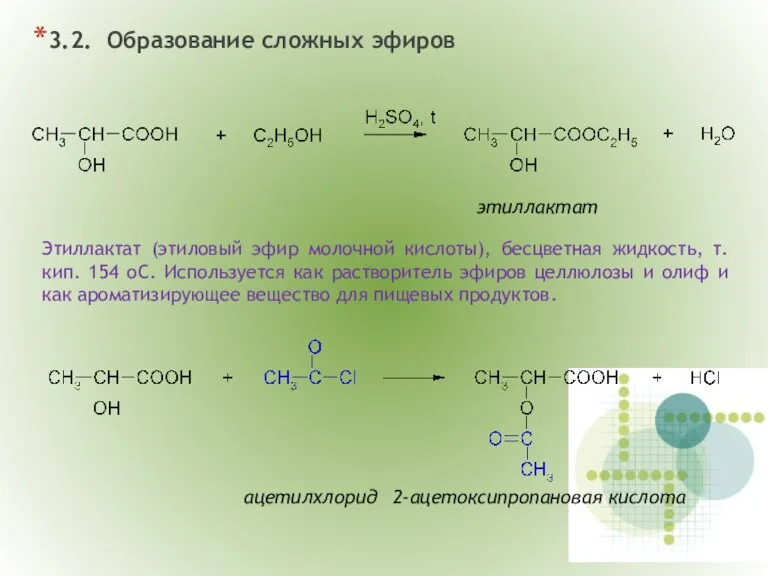
- 12. 3.2. Образование сложных эфиров этиллактат Этиллактат (этиловый эфир молочной кислоты), бесцветная жидкость, т.кип. 154 oC. Используется
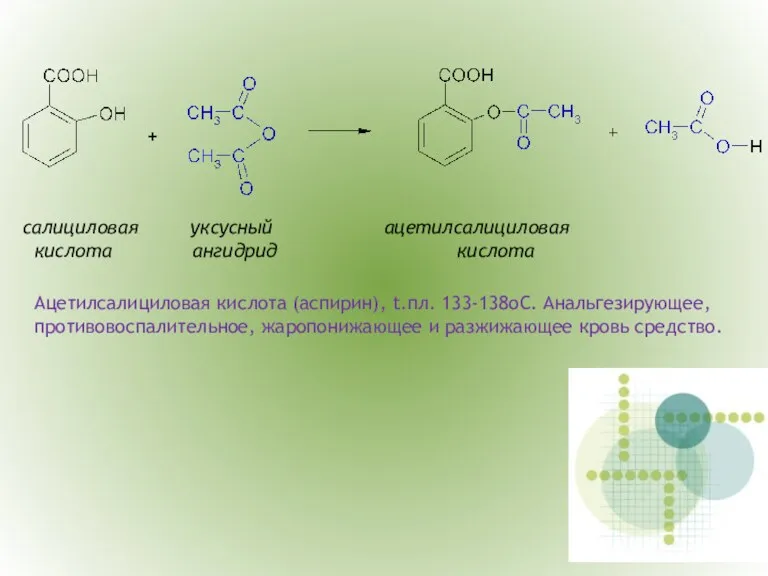
- 13. салициловая уксусный ацетилсалициловая кислота ангидрид кислота Ацетилсалициловая кислота (аспирин), t.пл. 133-138оС. Анальгезирующее, противовоспалительное, жаропонижающее и разжижающее
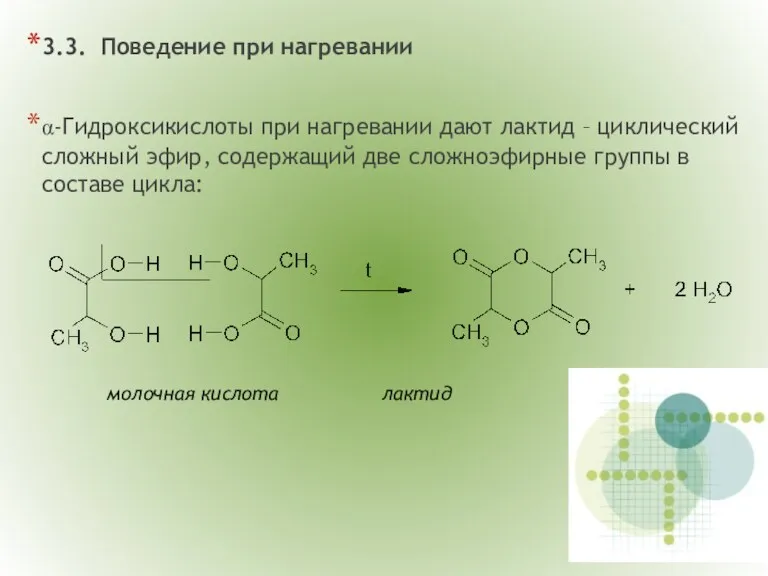
- 14. 3.3. Поведение при нагревании α-Гидроксикислоты при нагревании дают лактид – циклический сложный эфир, содержащий две сложноэфирные
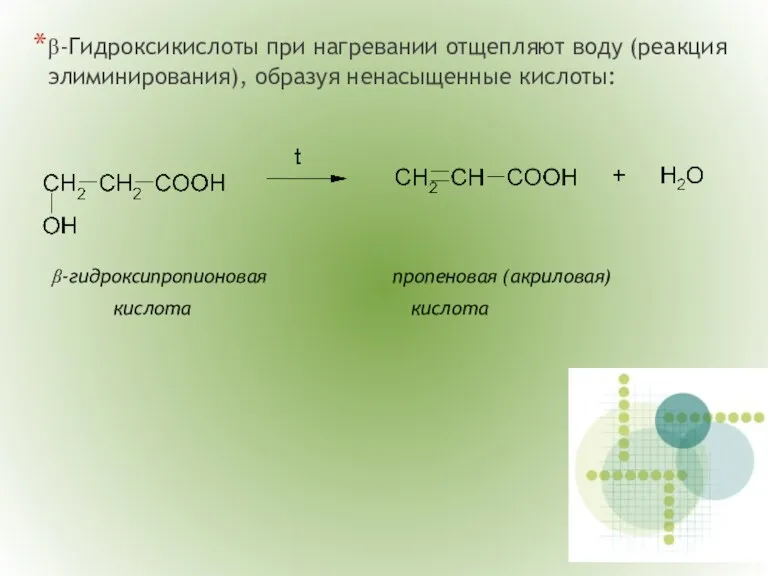
- 15. β-Гидроксикислоты при нагревании отщепляют воду (реакция элиминирования), образуя ненасыщенные кислоты: β-гидроксипропионовая пропеновая (акриловая) кислота кислота
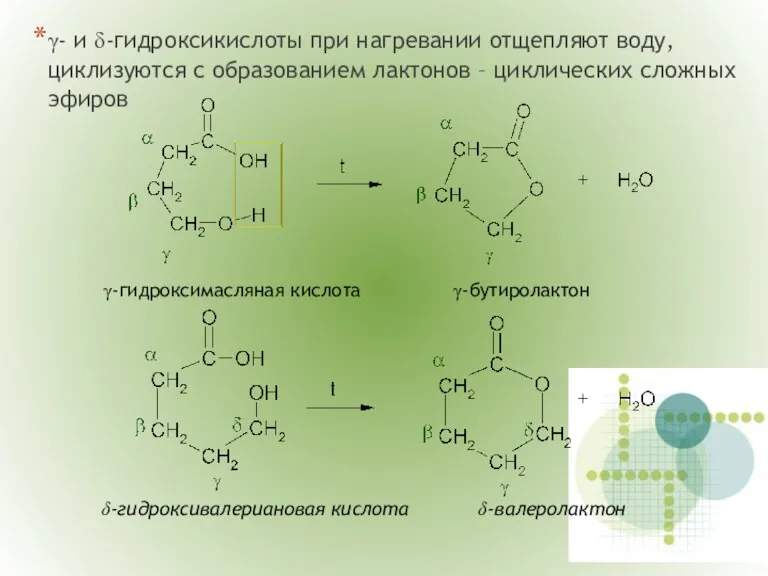
- 16. γ- и δ-гидроксикислоты при нагревании отщепляют воду, циклизуются с образованием лактонов – циклических сложных эфиров γ-гидроксимасляная
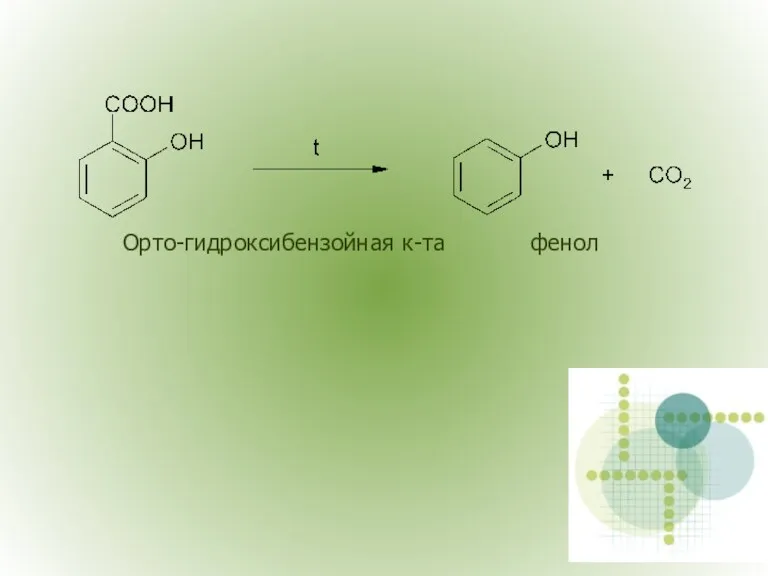
- 17. Орто-гидроксибензойная к-та фенол
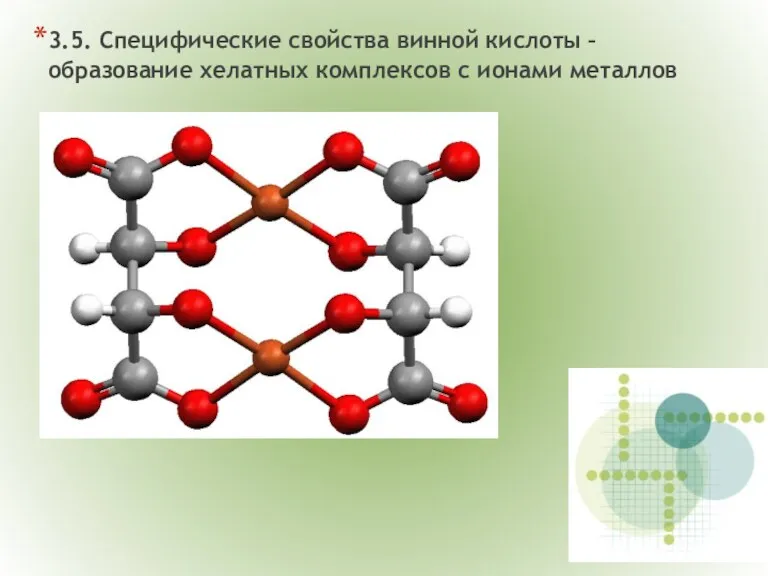
- 18. 3.5. Специфические свойства винной кислоты – образование хелатных комплексов с ионами металлов
- 19. 4. Получение 1. Из природных источников молочная кислота – из скисшего молока (К. Шееле, 1780), яблочная
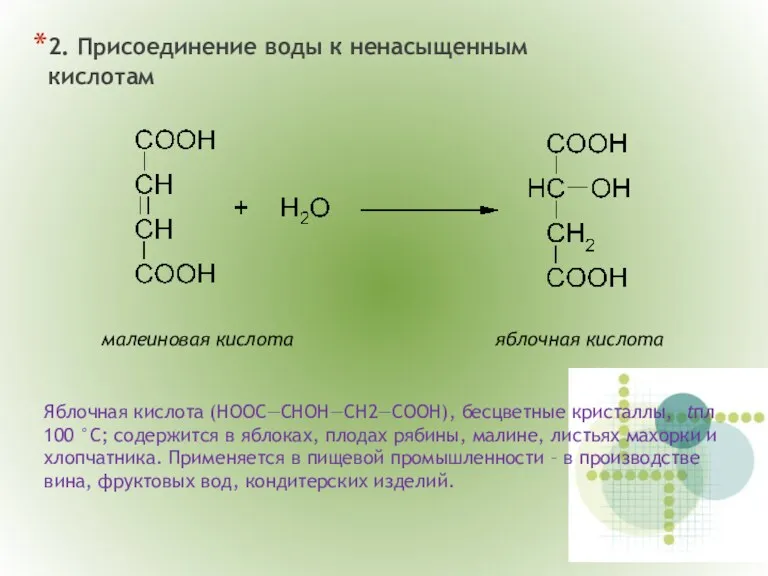
- 20. 2. Присоединение воды к ненасыщенным кислотам малеиновая кислота яблочная кислота Яблочная кислота (НООС—СНОН—СН2—CООН), бесцветные кристаллы, tпл
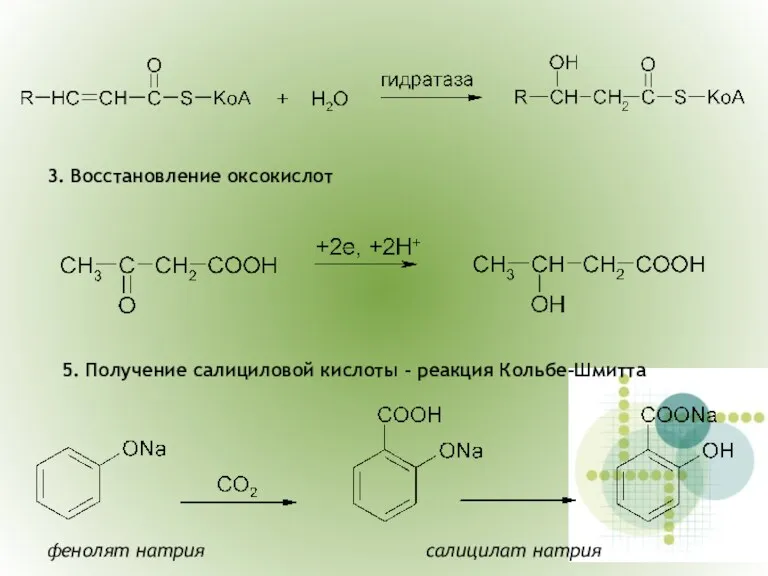
- 21. 3. Восстановление оксокислот 5. Получение салициловой кислоты - реакция Кольбе-Шмитта фенолят натрия салицилат натрия
- 23. Скачать презентацию




 Изомеры – это вещества, имеющие одинаковый состав
Изомеры – это вещества, имеющие одинаковый состав Природный газ
Природный газ Благородные металлы
Благородные металлы Типы химических реакций
Типы химических реакций General characteristics of halogens. Halogen compounds
General characteristics of halogens. Halogen compounds Свойства воды. Гидросфера
Свойства воды. Гидросфера Углеводороды (классификация и номенклатура)
Углеводороды (классификация и номенклатура) Прості і складні речовини. Метали і неметали
Прості і складні речовини. Метали і неметали Металлы и сплавы
Металлы и сплавы Создание слоев пористого кремния на p-Si
Создание слоев пористого кремния на p-Si становление органической химии
становление органической химии Ультраосновные породы (гипербазиты)
Ультраосновные породы (гипербазиты) Термодинамика
Термодинамика Роль хімії у розв`язанні екологічної проблеми
Роль хімії у розв`язанні екологічної проблеми Су - тіршілік көзі
Су - тіршілік көзі Амінокислоти
Амінокислоти Химия аминокислот. Лекция № 4
Химия аминокислот. Лекция № 4 Скорость химических реакций
Скорость химических реакций Сравнительный анализ установки изомеризации между Павлодарским НПЗ и Московским НПЗ
Сравнительный анализ установки изомеризации между Павлодарским НПЗ и Московским НПЗ Каучук туралы жалпы мәліметтер
Каучук туралы жалпы мәліметтер Обобщение по типам химических реакций
Обобщение по типам химических реакций Теория электролитической диссоциации
Теория электролитической диссоциации Строение электронных оболочек атомов химических элементов 8 класс
Строение электронных оболочек атомов химических элементов 8 класс Көміртек оксидтері
Көміртек оксидтері Химические реакции
Химические реакции Химическое равновесие. Классификация реакций по признаку обратимости
Химическое равновесие. Классификация реакций по признаку обратимости Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Гидроксид железа
Гидроксид железа