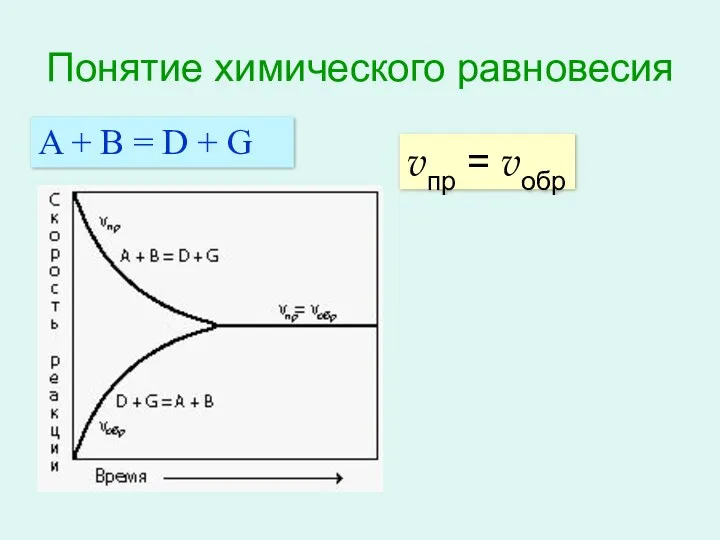
Принцип Ле Шателье
Анри Ле Шателье
(1850-1936)
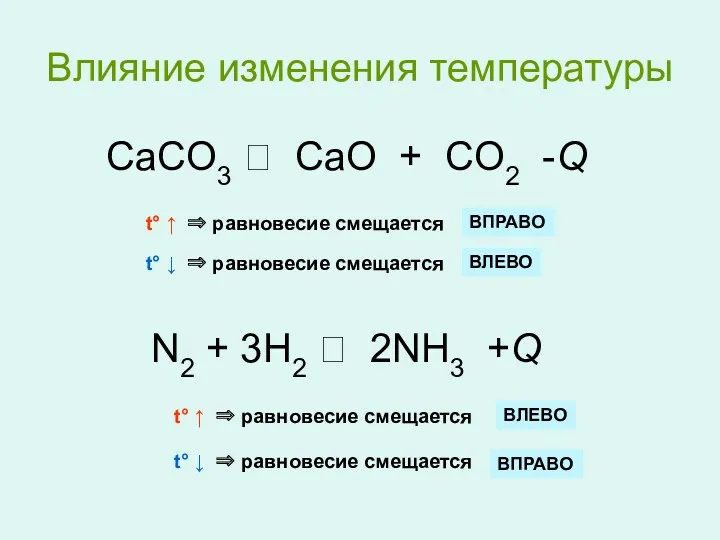
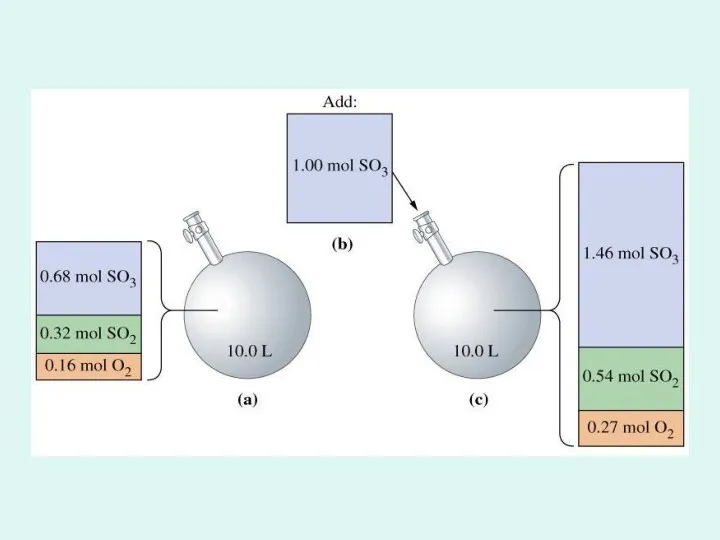
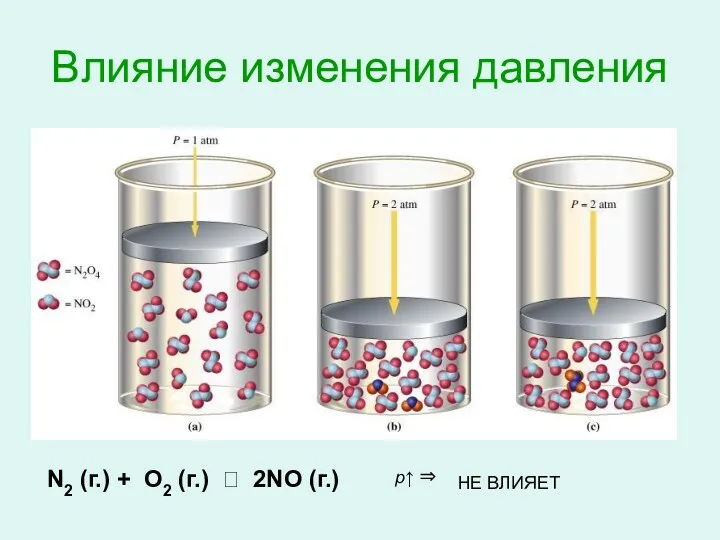
При изменении внешних условий
(t, p,
концентрация)
равновесие смещается
в сторону той реакции,
которая ослабит внешнее воздействие
«Любая система, находящаяся в состоянии устойчивого химического равновесия,
будучи подвергнута влиянию внешнего воздействия,
которое стремится изменить либо температуру, либо конденсированность
(давление, концентрацию, число молекул в единице объема)
всей системы или некоторых ее частей, может подвергнуться только
тем изменениям,
которые, если бы они происходили сами по себе,
вызвали бы изменение температуры
или конденсированности, противоположное по знаку тому изменению,
которое вызывается внешним воздействием».
Ле Шателье, 1884 г.

![Равновесные концентрации H2 (г.) + I2 (г.) 2HI (г.) [H2], [I2], [HI] – равновесные концентрации](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/604700/slide-3.jpg)









 Химические свойства алканов
Химические свойства алканов Особенности сжигания жидкого топлива и топливосжигающие устройства
Особенности сжигания жидкого топлива и топливосжигающие устройства Бериллий, магний и щелочноземельные металлы
Бериллий, магний и щелочноземельные металлы Галогены
Галогены Титриметрический анализ. (Лекция 22)
Титриметрический анализ. (Лекция 22) Стратегия химической промышленности
Стратегия химической промышленности Общие черты гидротермальных месторождений
Общие черты гидротермальных месторождений Степень окисления
Степень окисления Липиды, биологическая роль, классификация
Липиды, биологическая роль, классификация Альдегиды и кетоны
Альдегиды и кетоны Кислород и озон
Кислород и озон Типы химических реакций. Опыты
Типы химических реакций. Опыты Методика изучения галогенов, галогеноводородных кислот и их солей в курсе химии средней школы
Методика изучения галогенов, галогеноводородных кислот и их солей в курсе химии средней школы Реакции нейтрализации
Реакции нейтрализации Камень чароит
Камень чароит Теория строения органических веществ А.М. Бутлерова
Теория строения органических веществ А.М. Бутлерова Азотсодержащие органические соединения
Азотсодержащие органические соединения Закон триад. Открытие периодического закона
Закон триад. Открытие периодического закона Химический состав клетки. Неорганические соединения
Химический состав клетки. Неорганические соединения Газовые смеси
Газовые смеси Бытовая химия в нашем доме и альтернативные способы уборки
Бытовая химия в нашем доме и альтернативные способы уборки Теория электролитической диссоциации
Теория электролитической диссоциации Алкалоиды и принципы их классификации
Алкалоиды и принципы их классификации Алканы. Строение, номенклатура, изомерия, химические и физические свойства
Алканы. Строение, номенклатура, изомерия, химические и физические свойства Высокомолекулярные вещества полимеры
Высокомолекулярные вещества полимеры Химические свойства толуола
Химические свойства толуола Алканы. Способы получения алканов. Химические свойства алканов
Алканы. Способы получения алканов. Химические свойства алканов Химиялық элемент алюминий
Химиялық элемент алюминий